Grünes Licht für clevere Algen
Forscher untersuchen außergewöhnliche Lichtsammelproteine
Anzeigen
Pflanzliches Plankton ist nicht nur Fundament der Nahrungskette in den Ozeanen, sondern bindet über Photosynthese auch Kohlenstoff und produziert Sauerstoff. Dafür nutzt das sogenannte Phytoplankton Sonnenergie. Einen beachtlichen Teil des Phytoplanktons machen Cryptophyten, komplexe einzellige Algen, aus. Sie haben ihre Lichterntemechanismen im Lauf der Evolution stark an ihre Umgebung angepasst und können daher zum Beispiel auch grünes Licht nutzen. Forscher um Prof. Dr. Nicole Frankenberg-Dinkel decken erstmals Gemeinsamkeiten und Unterschiede beim Zusammenbau der Lichterntekomplexe der Cryptophyte Guillardia theta im Vergleich zu Cyanobakterien und Rotalgen auf. Die Veröffentlichung der Ergebnisse in der Zeitschrift „Journal of Biological Chemistry“ gehört zu den zwei Prozent der Publikationen, welche zum „Paper of the week“ gewählt wurden.
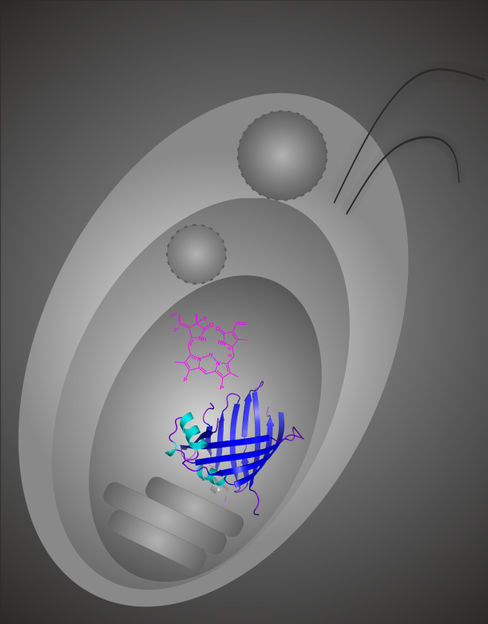
Die Abbildung zeigt schematisch die verschachtelt aufgebaute Cryptophytenzelle, in deren inneren Bereich, dem Plastidenstroma, sich das Anknüpfungsenzym GtCPES mit der Fass-ähnlichen Struktur befindet. Das Plastidenstroma ist der Arbeitsort von GtCPES, wo es für den Transport und die Anknüpfung des magentafarbenen Pigments Phycoerythrobilin an das Phycobiliproteingerüst zuständig ist.
© Kristina Overkamp
Cryptophyten: Matrjoschka-Puppe der Gewässer
Im Gegensatz zu klassischen eukaryotischen Zellen – also allen Zellen mit Zellkern – ähneln Cryptophytenzellen einer russischen Puppe in Form einer Alge in einer Alge. Ihre Entstehung beruht auf der Aufnahme und Integration einer Rotalge in eine eukaryotische Wirtszelle. Dadurch haben Cryptophyten die Fähigkeit zur Photosynthese erworben. Wie ihre Vorfahren, die Rotalgen, nutzen Cryptophyten dabei nicht nur den grünen Farbstoff Chlorophyll zur Lichternte, sondern können durch bläulich oder rötlich gefärbte Proteine – sogenannte Phycobiliproteine – auch das durch Chlorophyll reflektierte grüne Licht als Energiequelle nutzen. Nach der Integration der Rotalge wurde das Rotalgengenom im Laufe der Zeit teilweise reduziert und mit dem Wirtszellengenom vermischt. Dabei fanden eine Reihe von Veränderungen auf genetischer, biochemischer und physiologischer Ebene statt, die eine Anpassung an neue ökologische Nischen ermöglichten. So erhielten die Algen zum Beispiel das Grundprinzip der Photosynthese aufrecht, modifizierten es aber deutlich. Dies betrifft unter anderem die Art und Weise der Lichternte und hierbei vor allem die Phycobiliproteine, die sich stark von ihren Vorfahren aus Cyanobakterien und Rotalgen unterscheiden.
Geschützter Pigmenttransport im Fass
In vielerlei Hinsicht ist noch nicht verstanden, wie die Lichternte von Guillardia theta funktioniert. Wissenschaftler der RUB gewannen nun erste Einblicke in die komplexe Biosynthese cryptophytischer Phycobiliproteine. „Dabei kombiniert Guillardia theta offensichtlich bewährte und neuartige Synthesewege und Enzyme“, sagt Prof. Dr. Nicole Frankenberg-Dinkel. So ähnelt die Synthese des roten, für die Lichtaufnahme verantwortlichen Pigments Phycoerythrobilin der in Cyanobakterien. Dahingegen sind an der Anknüpfung der Pigmente an das Phycobiliproteingerüst sowohl bekannte als auch neuartige Enzyme beteiligt. Eines dieser Anknüpfungsenzyme, das GtCPES, konnten die Wissenschaftler um Prof. Frankenberg-Dinkel im Detail biochemisch und strukturell charakterisieren. In Zusammenarbeit mit Dr. Raphael Gasper-Schönenbrücher aus der Arbeitsgruppe Proteinkristallographie um Prof. Dr. Eckhard Hofmann konnten sie die atomare Struktur von GtCPES aufklären. GtCPES besitzt die Form eines nur am Boden geschlossenen Fasses, in dessen Öffnung ein bestimmtes Pigment, das Phycoerythrobilin, hineinpasst. Mithilfe des Fasses wird das empfindliche Pigment vor äußeren Einflüssen geschützt zum Zielort, dem Phycobiliproteingerüst, transportiert. Die strukturellen Eigenschaften der Fassoberseite gewährleisten dabei den Transfer des Pigments in der richtigen Orientierung an eine definierte Stelle des Proteingerüsts.