Nachricht aus der Poststelle der Zelle
Wichtiger Mechanismus des Proteintransports aufgeklärt
Zellen in einem Organismus kommunizieren miteinander über Botenstoffe. Dies sind oftmals Proteine, die im Zellinneren produziert, dann nach außen geschleust und an die Umgebung abgegeben werden. Wie genau dieser Exportvorgang aber im Einzelnen abläuft, ist bislang unklar. Forscher am MPI für Biochemie (MPIB) konnten nun detailliert zeigen, wie die ‚Poststelle der Zelle‘ einige der Proteine zuordnet, die aus der Zelle befördert werden. „Der gefundene Mechanismus steuert die korrekte Sortierung der Proteine und ist somit essenziell für den menschlichen Organismus“, verdeutlicht Julia von Blume, Forschungsgruppenleiterin am MPIB. Die Ergebnisse wurden im Journal of Cell Biology veröffentlicht.
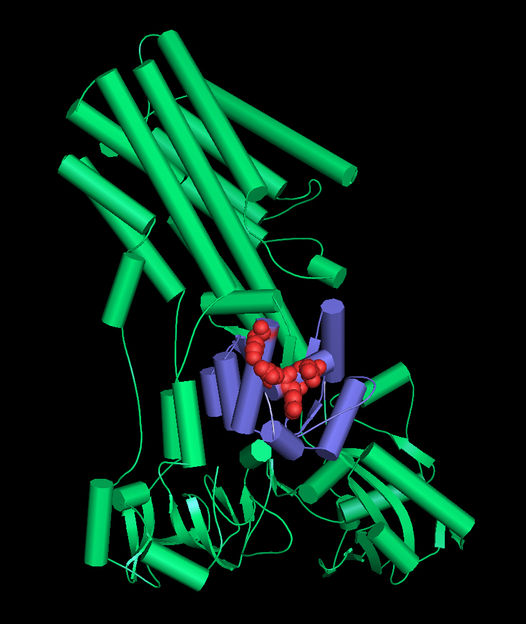
Strukturmodell des Kalziumtransportes SPCA1: Die Cofilin-Bindedomäne ist violett dargestellt. Die Aminosäurereste, die an der direkten Bindung zu Cofilin beteiligt sind, sind in Rot gezeigt.
Dr. Bianca Habermann / Copyright: MPI of Biochemistry
Ähnlich wie wir Menschen miteinander kommunizieren, können auch unsere Körperzellen kleine Nachrichten austauschen. Hierzu verwenden viele von ihnen oftmals Proteine als Botenstoffe, wie etwa Hormone. Diese werden im Zellinneren gefertigt und im Anschluss in einer Art zellulären ‚Poststelle‘, dem sogenannten Golgi-Apparat, für den Export in kleine Membranpakete, die Vesikel, verpackt und ausgeschleust. Da aber nicht alle Vesikel für den Export bestimmt sind, ist es entscheidend, dass die Proteine in die richtigen Vesikel einsortiert werden.
Julia von Blume und ihr Team der Forschungsgruppe „Molekulare Grundlagen des Proteintransports“ am MPIB widmen sich der Klärung dieser Frage. Sie konnten in vorangegangenen Studien bereits zeigen, dass das Zusammenspiel dreier Proteine beim Sortiervorgang entscheidend ist. So wirken das als zentrales Stütz- und Transportmolekül bekannte Aktin und ein als Cofilin bezeichneter Protein-Komplex zusammen. Sie binden nahe den Vesikeln den Kalziumtransporter SPCA1, der die lokale Konzentration von Kalzium erhöht. Das zieht die entsprechenden Proteine an, die dann in ein Vesikel eingeschlossen und aus der Zelle geschleust werden.
In der aktuellen Veröffentlichung klärten die Wissenschaftler nun den konkreten molekularen Mechanismus, der diesen Schritten zugrunde liegt. Indem sie die einzelnen Proteine sowohl isoliert als auch in lebenden Zellen untersuchten, konnten sie deren Zusammenspiel (bis auf die Aminosäure) genau aufschlüsseln.
Die neuen Erkenntnisse bestätigen aber nicht nur die vorangegangenen Studien, sondern sind zudem auch medizinisch relevant: „Die gefundene Regulation steuert die korrekte Sortierung der Proteine im Golgi-Apparat und ist somit essentiell für den menschlichen Organismus“, ordnet Julia von Blume die Ergebnisse ein und nennt ein Beispiel: „Ist dieser Prozess beeinträchtigt, können schwere Gesundheitsstörungen wie die Hauterkrankung Hailey-Hailey die Folge sein. Aufgrund eines genetischen Defekts funktioniert hier der Kalziumtransporter SPCA1 nicht. Man nimmt an, dass bestimmte Proteine, die für die Zell-Zell-Kommunikation in der Oberhaut wichtig sind, dadurch nicht mehr aus der Zelle ausgeschleust werden können.“ Patienten mit Hailey-Hailey leiden daher unter Verfärbungen der Haut, Juckreiz und Blasenbildung.
In Zukunft wollen die Wissenschaftler nun aufklären, ob weitere Proteine an dem Prozess beteiligt sind - immer mit dem Ziel, am Ende den ganzen Prozess rekonstruieren zu können.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
C. Kienzle, N. Basnet, A. Crevenna, G. Beck, B. Habermann, N. Mizuno and J. von Blume: Cofilin recruits F-actin to SPCA1 and promotes Ca2+-mediated secretory cargo sorting. Journal of Cell Biology, September 1, 2014.
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
KÖTTERMANN findet Investor
Sanofi-Aventis kauft größten Generikahersteller Brasiliens
Wenn Fresszellen Verdauungsprobleme haben - Wenn ein Sekret der Lungenbläschen nicht regelmäßig abgebaut wird, droht Atemnot
Molekulare Pinzette gegen HIV - Neuer Ansatz für Mikrobizide
Neuer Ansatzpunkt für Alzheimer-Forschung - Fresszellen verlieren langfristig schützende Funktion