Neue Waffe des Immunsystems entdeckt
Aryl-Hydrocarbon-Rezeptor bindet Bakterientoxine und leitet deren Zerstörung ein
Anzeigen
Max-Planck-Forscher haben einen völlig neuen Weg entdeckt, wie das Immunsystem Krankheitserreger erkennt. Der Aryl-Hydrocarbon-Rezeptor wurde lange Zeit nur von Pharmakologen und Toxikologen erforscht, weil er Umweltgifte erkennt. Doch auch im Immunsystem übernimmt er wichtige Aufgaben. Wissenschaftler um Stefan H. E. Kaufmann vom Max-Planck-Institut für Infektionsbiologie in Berlin haben herausgefunden, dass an den Aryl-Hydrocarbon-Rezeptor auch Virulenzfaktoren von in den Körper eingedrungenen Bakterien binden. Dadurch wird die angeborene Immunantwort aktiviert und die Faktoren werden sofort abgebaut. Mit dieser Erkenntnis haben die Wissenschaftler eine bislang unbekannte Komponente des Immunsystems identifiziert: Bakterielle Virulenzfaktoren können also nicht nur durch Antikörper neutralisiert, sondern auch direkt zerstört werden.
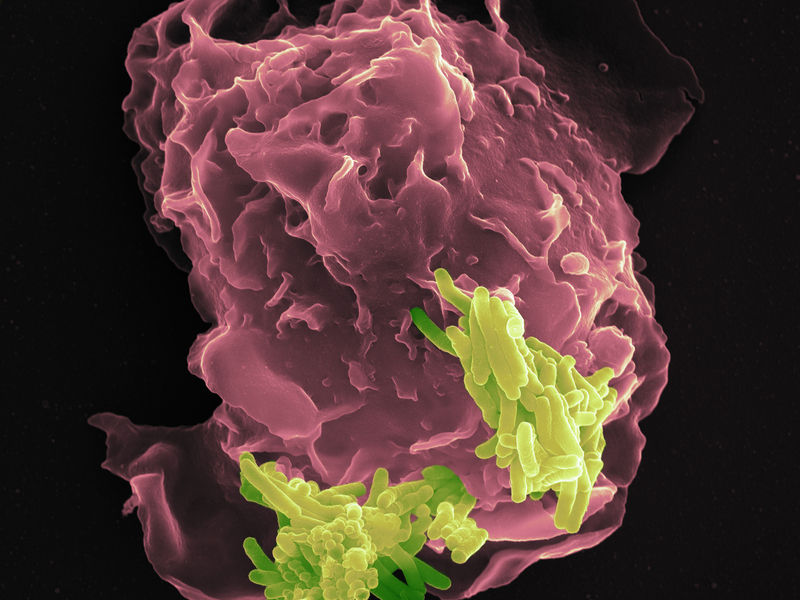
Kontaktaufnahme zwischen Tuberkulose-Erreger und Fresszelle (Makrophage). Der enge Kontakt zwischen Erreger und Abwehrzelle ermöglicht das Eindringen von Pigmenten wie Phthiocol in die Wirtszelle. Die Erkennung durch den Aryl-Hydrocarbon-Rezeptor führt zur raschen Mobilisierung von Abwehrmaßnahmen.
© MPI for Infection Biology / Volker Brinkmann
Bislang galt unter Immunbiologen als unwahrscheinlich, dass das Immunsystem bakterielle Virulenzfaktoren unmittelbar zerstört. Die Rolle des Aryl-Hydrocarbon-Rezeptors ist daher besonders überraschend. Er wird von vielen Körperzellen einschließlich Immun- und Epithelzellen gebildet. Bisher war der Rezeptor vor allem als Andockstelle für Umweltgifte bekannt. Dazu zählt beispielsweise das extrem schädliche TCDD – ein Dioxin, das bereits in kleinsten Konzentrationen schwerste Organschäden auslöst. „Es gibt ihn jedoch bei unterschiedlichsten Organismen von Fadenwürmern über Insekten bis hin zum Menschen. Wenn so viele Lebewesen ihn besitzen, dann sicher nicht nur, um Umweltgifte zu erkennen, sondern auch um sich gegen Infektionen zu verteidigen“, sagt Pedro Moura-Alves vom Max-Planck-Institut für Infektionsbiologie.
Die Wissenschaftler haben deshalb nach bakteriellen Molekülen gesucht, die ähnlich aufgebaut sind wie bereits bekannte Bindungspartner des Aryl-Hydrocarbon-Rezeptors. Fündig wurden sie unter den Pigmentstoffen der Bakterien, die die Erreger schützen, den Körper aber schädigen. Mathematischen Modellen zufolge passen sowohl die grün-blauen Phenazine des Hospitalismuskeims Pseudomonas aeruginosa, der Atemwegsinfektionen auslöst, als auch das gelbe Naphthochinon Phthiocol des Tuberkulose-Erregers Mycobacterium tuberculosis in die Bindungstasche des Rezeptors.
Experimente an Mäusen bestätigten dann, wie wichtig der Aryl-Hydrocarbon-Rezeptor für die Immunantwort ist. Tiere ohne diesen Rezeptor weisen nach der Infektion mit den Lungenkeimen stärkere Krankheitssymptome auf, haben mehr Bakterien in der Lunge und sterben öfter. Offenbar erkennt das Immunsystem den Feind ohne den Aryl-Hydrocarbon-Rezeptor nicht früh genug. „Für den Erreger sind die bakteriellen Virulenzfaktoren Segen und Fluch zugleich: Sie ermöglichen einerseits die Infektion des Wirtsorganismus, andererseits helfen Sie dem Wirt, den Erreger aufzuspüren“, sagt Kaufmann.
Das Besondere ist, dass der Aryl-Hydrocarbon-Rezeptor die bakteriellen Pigmente direkt bindet und daraufhin selbst im Zellkern die Expression zahlreicher Gene für den Abbau der Virulenzfaktoren anschaltet. Er wandert dazu von der Außenseite in das Innere des Zellkerns, wo er sich an die DNA anlagert. Der Aryl-Hydrocarbon-Rezeptor ist damit Rezeptor und Transkriptionsfaktor in einem und kann deshalb extrem schnell auf eine Infektion reagieren. Die meisten anderen Rezeptoren des Immunsystems sind hingegen auf Helferproteine angewiesen, die die Information über Krankheitserreger in den Zellkern weiterleiten.
Als nächstes wollen die Wissenschaftler herausfinden, mit welchen anderen Transkriptionsfaktoren der Aryl-Hydrocarbon-Rezeptor interagiert und welche Enzyme genau für den Abbau der bakteriellen Virulenzfaktoren verantwortlich sind.