Pilzgift schützt vor Fadenwürmern
Forscher der ETH Zürich isolierten aus einem Wurzelpilz der Fichte ein Protein, das Fadenwürmer bekämpft. Die Wissenschaftler hoffen, dass solche Gifte die Basis für eine Impfung von Nutz- oder Haustieren gegen parasitische Fadenwürmer werden.
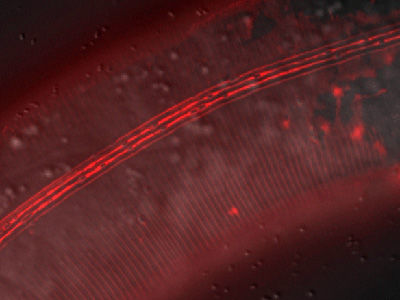
Das Pilzgift dockt an spezifische Zuckerstrukturen auf der Oberfläche von Darmzellen des Fadenwurms C. elegans an. Dort, wo sich das Gift anreichert, leuchten die Oberflächenstrukturen hell rot.
Alex Butschi / Universität Zürich
Die meisten landlebenden Pflanzen gehen mit Pilzen Lebensgemeinschaften ein. Davon profitieren beide: Der Pilz, der Würzelchen der Wirtspflanze mit einem dichten Filz umhüllt, beschafft der Pflanze Spurenelemente und Wasser. Die Pflanze ihrerseits versorgt den Pilz mit Zuckern und anderen Stoffwechselprodukten, die dieser nicht selbst herstellen kann.
Toxisches Protein tötet Darmzellen ab
In den Zellen eines solchen Wurzelpilzes haben nun ETH-Forschende aus der Gruppe von Mikrobiologieprofessor Markus Aebi ein Protein entdeckt, das für das Pilz-Pflanze-Gespann einen weiteren Vorteil hat: Es schützt den Pilz und möglicherweise auch die Wurzeln vor Fadenwürmern, denn es ist für die Parasiten toxisch. «Dieses Gift ist wahrscheinlich Teil des Abwehrsystems dieses Pilzes gegen Fressfeinde», sagt Markus Künzler, Oberassistent in Aebis Gruppe. Fressen die Fadenwürmer Pilzzellen, nehmen sie das toxische Protein auf, wodurch die Darmzellen des Wurms über einen noch nicht verstandenen Mechanismus zerstört werden.
Der Pilz bildet das Protein vor allem in seinem Hut, also dem über dem Boden sichtbaren Fruchtkörper, und im dichten Pilzgeflecht rund um die Wurzelspitzen. Dass das Gift nahe der Wurzelspitzen vorhanden ist, könnte darauf hindeuten, dass der Pilz mit dem Gift nicht nur sich selbst, sondern auch die Pflanzenwurzel vor Fressfeinden schützen könnte. Viele im Boden lebende Fadenwürmer können sich nämlich nicht nur von Pilzgewebe, sondern auch von Pflanzenzellen ernähren.
Modifizierter Zucker als Andockstelle
In ihrer Studie, die in der Fachzeitschrit PNAS erschienen ist, zeigen die Forscher auf, dass das Abwehrprotein an einen spezifischen Angriffspunkt des Fadenwurms andockt: an einen modifizierten Zucker, den es auf den Oberflächen der Wurmdarmzellen aber auch auf denen von Weichtieren wie Schnecken gibt. Auf Zellen von Vertebraten scheint diese Oberflächenstruktur nicht vorhanden zu sein.
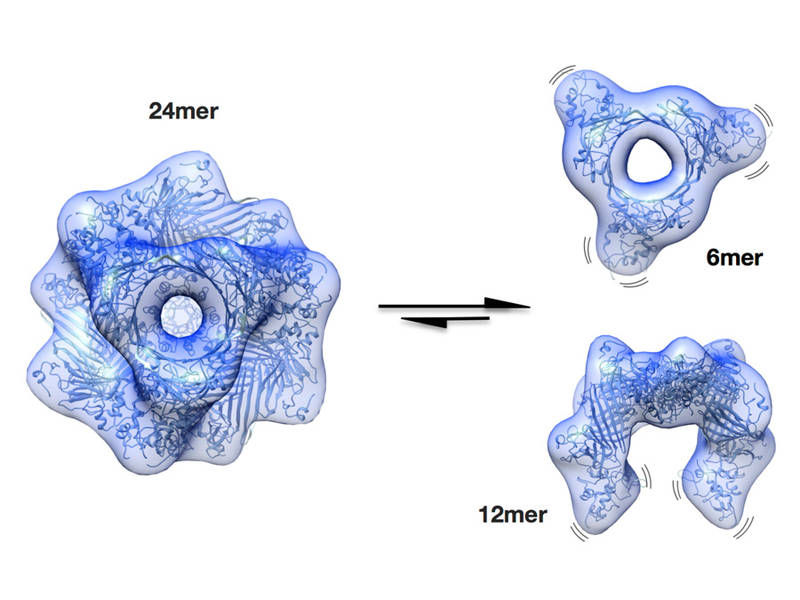
Weiter konnten Künzler und seine Mitarbeiter zeigen, dass dieser Angriffspunkt ebenfalls auf bestimmten Bakterien vorkommt, sodass das giftige Protein auch dort andocken kann. Da das Protein mehrere Bindungsstellen für die Zielstruktur besitzt, bilden das Protein und mehrere Bakterien Klumpen, sie «agglutinieren».
«Diese Reaktion ist interessant, da nahe Verwandte dieses Proteins, sogenannte Homologe, auch bei Tieren - von Wirbellosen wie Pfeilschwanzkrebsen bis zum Menschen - gefunden wurden und dort eine Rolle in der Abwehr gegen Bakterien spielen», führt Künzler weiter aus.
Dass pilzliche wie tierische Giftproteine an dieselben Zielstrukturen binden, bedeutet, dass dieser Abwehrmechanismus entwicklungsgeschichtlich sehr alt sein muss. Diese Art von Abwehr gehört zum «angeborenen» Abwehrsystem von so verschiedenen Organismengruppen wie Pilzen, Krebsen oder auch des Menschen.
Nutztiere gegen Parasiten impfen
Die Erkenntnis ebnet auch den Weg für praktische Anwendungen: Der ETH-Spin-off Malcisbo, der aus dem Labor der Mikrobiologen hervorgegangen ist, versucht, auf Basis solcher Oberflächenzuckerstrukturen neuartige Impfstoffe gegen Parasiten und krankmachende Keime für Nutztiere und Menschen hervorzubringen. «Die Pilze enthüllen uns die Achillesfersen von Fadenwürmern und Bakterien. Diese Erkenntnisse können wir nun nutzen, um sie zu bekämpfen», hofft Künzler.
Originalveröffentlichung
Wohlschlager T, et al. Methylated glycans as conserved targets of animal and fungal innate defense. PNAS Early Edition, published online 26 May 2014.