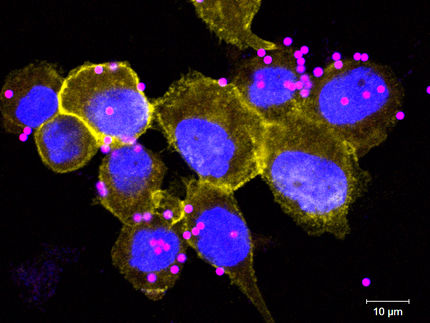
Kleine Eiweißmoleküle als potenzielle Antibiotika
Forscher entschlüsseln Wirkung eines antimikrobiellen Peptides auf Bakterienzellen
Kleine Moleküle aus Aminosäuren greifen Bakterien auf verschiedenen Wegen an und könnten eine neue Generation von Antibiotika darstellen. Wie genau eine bestimmte Art dieser sogenannten Peptide Bakterienzellen tötet, haben Biologen der Ruhr-Universität Bochum (RUB) erforscht. „In zehn Jahren schlägt möglicherweise keins der derzeit zugelassenen Antibiotika mehr an, da die Bakterien gegen alle Wirkstoffe resistent geworden sind“, sagt Juniorprofessorin Dr. Julia Bandow. Daher sei es höchste Zeit, neue antibakterielle Medikamente zu entwickeln. Gemeinsam mit Kollegen aus Deutschland, Österreich und Kanada berichtet sie in der Zeitschrift „Proceedings of the National Academy of Sciences USA“ (PNAS).
© RUB, Bild: Wenzel
Genaue Wirkweise muss für die Zulassung als Arzneimittel bekannt sei
Das Team um Julia Bandow, Leiterin der RUB-Nachwuchsgruppe Mikrobielle Antibiotikaforschung, untersuchte das Peptid MP196, stellvertretend für die Gruppe der sehr kleinen positiv geladenen Peptide, die aus vier bis zehn Aminosäuren bestehen können. Frühere Studien zeigten, dass MP196 effizient gegen verschiedene Bakterien wirkt, unter anderem gegen die besonders problematischen multiresistenten Keime, die häufig in Krankenhäusern auftreten und zum Beispiel eine Blutvergiftung auslösen können. Wie genau MP196 seine Wirkung entfaltet, war aber nicht klar. Um jedoch für eine neue Substanz eine Zulassung als Arzneimittel zu bekommen, muss der Wirkmechanismus im Detail bekannt sein.
Peptid stört Zellwandsynthese und Zellatmung
Diese Lücke schlossen die Biologen. Sie wiesen nach, dass sich das Peptid MP196 in die bakterielle Zellmembran einlagert. Dadurch verdrängt es bakterielle Zellmembranproteine, die lebenswichtige Prozesse regulieren. Zwei Prozesse sind besonders betroffen: MP196 stört die Synthese der Zellwand, also der äußeren Hülle, die die Zellmembran umgibt und dem Bakterium Stabilität verleiht. Außerdem behindert es die Zellatmung und als Folge davon die Produktion des Energiespeichermoleküls ATP. Das wiederum führt zu einem Energiemangel in der Bakterienzelle, der den Aufbau aller möglichen für das Bakterium lebenswichtigen Moleküle verhindert.
Entwicklung von Resistenzen gegen MP196 ist besonders kompliziert
„MP196 stört also eine ganze Palette von zellulären Prozessen, die an der Membran stattfinden“, sagt Julia Bandow. „Vermutlich ist das der Grund, warum eine Resistenzentwicklung gegen dieses Peptid schwierig ist.“ Die Forscher sind zuversichtlich, dass es mit MP196-ähnlichen Peptiden möglich ist, Medikamente herzustellen, die gezielt bestimmte Klassen von Bakterien angreifen, ohne menschliche Zellen zu schädigen. Denn wie MP196 mit der Zellmembran interagiert, hängt davon ab, welche Fettsäuremoleküle in der Membran vorhanden sind. Und diese Membranzusammensetzung variiert nicht nur zwischen Mensch und Bakterien, sondern auch zwischen unterschiedlichen Klassen von Bakterien.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Bahnbrechende Entdeckung wird die Herstellung von erneuerbaren Materialien aus Bäumen und Mais ermöglichen - Ein Start-up will es umsetzen
Leuchten entlarvt gefährliche Bakterien - Chemilumineszenz-Sonden für schnellen empfindlichen Nachweis von Salmonellen und Listerien

Carl Zeiss Vision GmbH - Aalen, Deutschland
BioPark Regensburg richtet "Interdisziplinaritäts-Agentur BIOTECH" ein
1,2,4-Trichlorbenzol
Tödliches Bornavirus vom Bunthörnchen auf Mensch übertragbar

Advitech Inc. - Québec, Kanada

Coronaviren: Auf schnellstem Weg zum Impfstoff
Covidien gibt neue Quelle grundlegender medizinischer Isotope bekannt - Zusätzlicher polnischer Forschungsreaktor hilft bei weltweitem Lieferengpass