Einmaliger Schnappschuss eines arbeitenden Enzyms
Göttinger Wissenschaftler entschlüsseln grundlegende Wirkprinzipien biochemischer Reaktionen
Enzyme sind die molekularen Katalysatoren des Lebens mit vitalen Funktionen im Stoffwechsel jeder Zelle. Bisher wurde spekuliert, dass Enzyme bei der Durchführung biochemischer Reaktionen ihre Ausgangsstoffe regelrecht verbiegen und dadurch spalten können. Wissenschaftlern am Göttinger Zentrum für Molekulare Biowissenschaften (GZMB) ist es nun erstmals gelungen, diese Hypothese zweifelsfrei experimentell zu bestätigen.
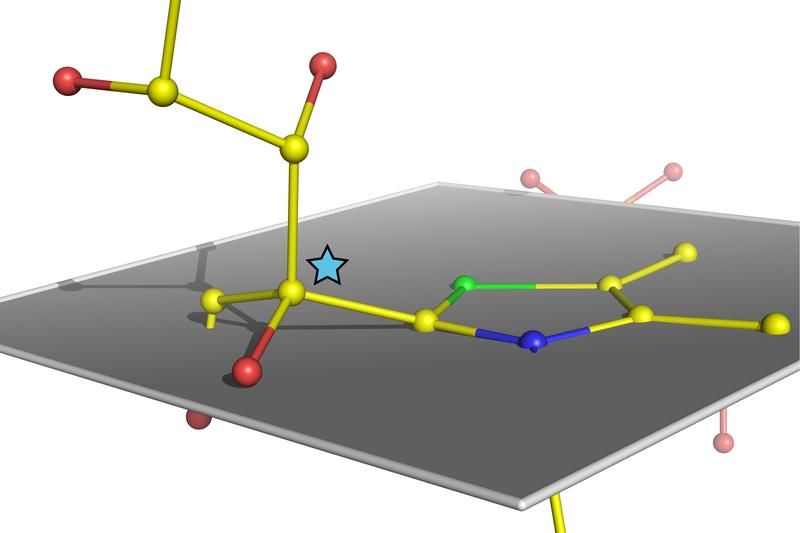
Atomare Struktur eines verbogenen, kurz vor der Spaltung stehenden Zuckermoleküls im humanen Enzym Transketolase. Der Stern markiert ein Kohlenstoffatom des Zuckers, das aus der eigentlich zu erwartenden Position innerhalb der grau definierten Ebene mehr als 20 Grad herausgehoben ist.
Universität Göttingen
Die Göttinger Wissenschaftler unter der Leitung von Prof. Dr. Kai Tittmann und Prof. Dr. Ralf Ficner züchteten zunächst hochgeordnete Proteinkristalle des humanen Enzyms Transketolase, das eine Schlüsselrolle bei der Verwertung von Zuckern im menschlichen Stoffwechsel einnimmt. Diese Proteinkristalle versetzten sie mit den natürlichen Zuckersubstraten. Die Analyse der Struktur des Enzymkristalls erfolgte anschließend an Teilchenbeschleunigern in Berlin und im französischen Grenoble. Den an dieser Studie maßgeblich beteiligten Wissenschaftlern des GZMB, Dr. Stefan Lüdtke und Dr. Piotr Neumann, gelang es, eine ultrahochaufgelöste Struktur des im Enzym gebundenen Zuckermoleküls unmittelbar vor seiner Spaltung in zwei Teile zu bestimmen. „Dieser in seiner Schärfe bis heute einmalige Schnappschuss eines arbeitenden Enzyms offenbart unzweifelhaft, dass das Zuckersubstrat im Enzym verbogen wird wie ein eingespanntes Werkstück in einem Schraubstock“, sagt Prof. Tittmann.
Enzyme stellen oft Angriffspunkte für Medikamente dar. Deshalb sind die neuen Erkenntnisse wichtig für die Entwicklung maßgeschneiderter, hochspezifischer Wirkstoffe, wie zum Beispiel für die Krebstherapie. „Auch die in der vorliegenden Studie untersuchte humane Transketolase übt eine Schlüsselfunktion im Stoffwechsel von Krebszellen aus“, sagt Prof. Tittmann.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.