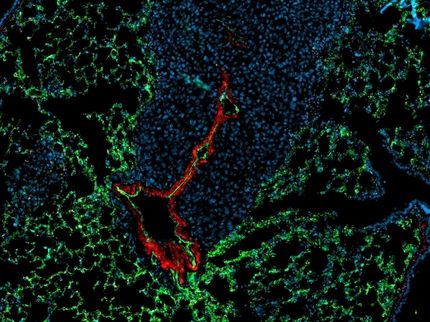
Das Ankerprotein
Biologen der Universität Konstanz haben in Zusammenarbeit mit Wissenschaftlern des University College Dublin (Irland) die Funktion eines Proteins entschlüsselt, das die Zellwanderung reguliert
Die Metastasierung von Krebszellen ist für etwa 90 Prozent der Krebstodesfälle verantwortlich. Die zelluläre Grundlage für die Metastasierung liegt in der Fähigkeit zur gerichteten Zellwanderung. Dr. Hesso Farhan, Arbeitsgruppenleiter am Biotechnologie Institut Thurgau (BITg) an der Universität Konstanz, hat gemeinsam mit seinem Team herausgefunden, dass durch das Ausschalten eines Proteins namens STYX die Wanderung von Zellen verhindert werden könnte. Die Ergebnisse sind in PNAS erschienen.
Wandern kranke Zellen, können sie im Körper großen Schaden anrichten. Sogenannte „MAP kinases“ (MAPK) regulieren die Zellmigration und spielen in der Zellforschung eine sehr wichtige Rolle. Zusätzlich zur Zellmigration sind MAPKs von entscheidender Bedeutung für die Teilung von Zellen (Zellproliferation) sowie auch bei deren Entartung, was als Vorstufe von Krebs gilt. MAPKs befinden sich im Innern der Zelle. Das Team um Hesso Farhan und Dr. Veronika Reiterer, Postdoc in Farhans Arbeitsgruppe, hat herausgefunden, dass das Protein STYX als Anker für MAPKs fungiert und diese Proteine im Zellkern hält. Zusätzlich gelang es durch Kollaboration mit Prof. Boris Kholodenko, Prof. Walter Kolch und Dr. Dirk Fey, Wissenschaftler am University College Dublin, ein computerisiertes Model der Zelle zu erstellen, um Vorhersagen zu treffen, wie und wo STYX die MAPKs reguliert. Diese Vorhersagen wurden durch eine Kombination von zellbiologischen, mikroskopischen und biochemischen Versuchen bestätigt. Nachdem nun der Effekt von STYX auf MAPKs identifiziert wurde, beschäftigte sich das Team um Farhan mit der Frage, ob STYX auch die Zellmigration reguliert.
Damit Zellen wandern können, benötigen sie den sogenannten „Golgi-Apparat“, der in jeder Zelle vorhanden ist. Man kann ihn sich als Kompass für die die zielgerichtete Zellwanderung vorstellen – der Golgi-Apparat gibt die Richtung vor. Wird nun das Protein STYX in der Zelle ausgeschaltet, „explodiert“ der Golgi-Apparat: Aus einem zusammenhängenden Kompass werden viele kleine. Die Zelle ist daher nicht mehr in der Lage gerichtet zu wandern. Theoretisch ergibt sich daraus die Schlussfolgerung, dass ein Ausschalten von STYX eine Option in der Krebstherapie wäre. Tatsächlich existieren mindestens vier Studien in denen gezeigt wurde, dass STYX in Brustkrebs erhöht ist. Wie genau das STYX-Protein ausgeschaltet werden kann, will Farhan gemeinsam mit seinem Team in Zukunft erforschen.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.