So könnte Alzheimer entstehen
Proteinkugeln im Kern geben Fehlsignal zur Zellteilung
Eine neue Hypothese, wie die Alzheimer-Krankheit entstehen könnte, haben Bochumer Forscher aufgestellt. Sie analysierten das Zusammenspiel der Proteine FE65 und BLM, die die Zellteilung regulieren. Im Zellkulturmodell entdeckten sie im Kern Kugelstrukturen, die FE65 und BLM enthielten. Die Interaktion der Proteine löste ein Fehlsignal zur Zellteilung aus. Dieses könnte die Degeneration und den Tod von Nervenzellen bei Alzheimer-Patienten erklären. Die Ergebnisse berichtet das Team um Dr. Thorsten Müller und Prof. Dr. Katrin Marcus aus der Abteilung Funktionelle Proteomik in Kooperation mit dem Medizinischen Proteom-Center der RUB geleitet von Prof. Helmut E. Meyer.
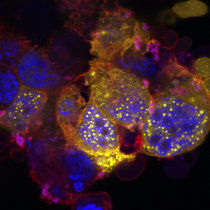
Die fluoreszenzmikroskopische Aufnahme zeigt mehrere im Labor kultivierte Zellen. Im Zellkern (hier blau gefärbt) fusioniert das Protein FE65 mit anderen Proteinen wie etwa BLM zu Kugelstrukturen, die in Gelb erkennbar sind. In Rot erscheint das Zytoskelett der Zelle, ein sehr flexibles, aus Proteinen aufgebautes Geflecht im Zytoplasma.
© Thorsten Müller
Komponenten von Kugelstrukturen im Zellkern identifiziert
Das sogenannte amyloide Vorläuferprotein APP ist von zentraler Bedeutung für die Alzheimer-Erkrankung. Es durchspannt die Zellmembran, und seine Spaltprodukte stehen in Verbindung mit Proteinablagerungen, die sich bei Alzheimer-Patienten außerhalb der Nervenzellen bilden. APP verankert das Protein FE65 an der Membran, welches im Zentrum der aktuellen Studie stand. FE65 kann in den Zellkern wandern; dort spielt es eine Rolle bei der DNA-Vervielfältigung und -Reparatur. Anhand von im Labor gezüchteten Zellen stellte das Team um Dr. Müller fest, dass sich FE65 mit anderen Proteinen im Zellkern zu Kugelstrukturen, sogenannten „nuclear spheres“, zusammenschließen kann. Videomikroskopische Aufnahmen zeigten, dass diese ringartigen Strukturen miteinander verschmelzen und dadurch wachsen können. „Durch ein spezielles Zellkulturmodell waren wir in der Lage, weitere Komponenten dieser Kugeln zu identifizieren“, sagt Andreas Schrötter, Doktorand in der Arbeitsgruppe Morbus Alzheimer am Institut für Funktionelle Proteomik. Unter anderem fanden die Wissenschaftler das Protein BLM, das aus dem Bloom-Syndrom bekannt ist – einer sehr seltenen erblichen Krankheit, die etwa mit Minderwuchs, Immunschwäche und erhöhtem Krebsrisiko einhergeht. BLM ist an der DNA-Vervielfältigung und -Reparatur im Zellkern beteiligt.
Die Menge von FE65 bestimmt die BLM-Menge im Zellkern
Müllers Team nahm die Funktion von FE65 genauer unter die Lupe. Durch genetische Manipulation erzeugten die Forscher Zellkulturen, in denen die FE65-Produktion heruntergefahren war. Eine geringere FE65-Menge bedingte dabei eine geringere Menge des Proteins BLM im Zellkern; stattdessen sammelte sich BLM in einem anderen Bereich der Zelle an, dem Endoplasmatischen Retikulum. Außerdem fanden die Wissenschaftler eine niedrigere DNA-Vervielfältigungsrate in den genetisch veränderten Zellen. So beeinflusst FE65 über das Protein BLM die Replikation der Erbsubstanz. Kurbelten die Forscher die FE65-Herstellung wieder an, vergrößerte sich auch die BLM-Menge im Zellkern wieder.
FE65 als möglicher Alzheimer-Auslöser
Bei Patienten mit Alzheimerscher Krankheit ist das Protein APP, ein Interaktionspartner von FE65, verändert. Das Zusammenspiel der beiden Moleküle ist wichtig für den Transport von FE65 in den Zellkern, wo dieses in Verbindung mit BLM die Zellteilung reguliert. Müllers Team vermutet, dass die veränderte APP-FE65-Interaktion den Zellen fälschlicherweise das Signal sendet, sich zu teilen. Da Nervenzellen sich in der Regel nicht teilen können, degenerieren sie stattdessen und sterben ab. „Diese Hypothese, die wir in der Arbeitsgruppe Morbus Alzheimer weiter verfolgen, liefert auch neue Ansatzpunkte für etwaige Therapiemöglichkeiten, die für die Alzheimer-Erkrankung dringend benötigt werden“, sagt Dr. Müller. In Zukunft wird das Team auch untersuchen, ob und wie die BLM-Menge bei Alzheimer-Patienten im Vergleich zu Gesunden verändert ist.



























































