HIH: Parkinson im Reagenzglas
Hirnforscher korrigieren DNA-Mutation an humanen Stammzellen
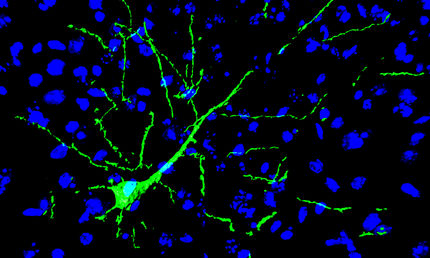
Hirnforschern aus Tübingen und Münster ist es gelungen, eine bestimmte Parkinson-DNA-Mutation humaner Stammzellen im Reagenzglas zu korrigieren – und zwar die sogenannte G2019S Mutation im LRRK2-Gen. Sie ist die häufigste genetische Mutation bei Parkinson-Patienten. Im Reagenzglas wurde anschließend nachgeahmt was im Gehirn mit den Nervenzellen passiert: die Gen-korrigierten Zellen zeigten keine Neurodegeneration. Sie verhielten sich somit wie gesunde Nervenzellen. Die Studie zeigte außerdem, dass die G2019S-Mutation eine bestimmte Proteinsignalkette überaktiviert und dadurch zum Absterben der Nervenzellen bei Morbus Parkinson beiträgt.
„Uns ist es gelungen eine Genkorrektur im Reagenzglas durchzuführen und dadurch einen direkten Einblick in die Wirkungsweise der Mutation in menschlichen Nervenzellen zu gewinnen“, sagt Professor Dr. med. Thomas Gasser, Vorstandsvorsitzender am Hertie Institut für klinische Hirnforschung (HIH) der Universität-Tübingen sowie Sprecher am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) am Standort Tübingen. „Außerdem zeigten wir, dass stammzellbasierte Zellmodelle sich in der Tat dazu eignen, Parkinson im Reagenzglas darzustellen und somit eine bessere und genauere Erforschung der Parkinson-Krankheit auch ohne Tiermodelle zu ermöglichen“, ergänzt Dr. Jared Sterneckert, Gruppenleiter am Max-Planck-Institut für molekulare Biomedizin, Münster. Überdies entdeckten die Hirnforscher einen weiteren molekularen Mechanismus, der den Untergang der Dopamin-produzierenden Nervenzellen fördert. Bei Parkinson sterben nach und nach diese Nervenzellen in einer kleinen, genau umrissenen Region des Mittelhirns vollständig ab. Die schwarze Pigmentierung dieser Neurone gibt dieser Region ihren Namen: Substantia nigra.
Neue Technologien ermöglichen Genkorrektur im Reagenzglas
Um die Ergebnisse der Studie zu ermöglichen, haben Forscher des Hertie-Instituts für klinische Hirnforschung in Tübingen gemeinsam mit dem Max-Plack-Institut für molekulare Biomedizin in Münster zwei neue Verfahren kombiniert: Zum einen reprogrammierten sie Hautzellen Parkinson-Kranker zunächst zu humanen induzierten pluripotenten Stammzellen (hiPSC) um und differenzierten sie dann durch eine Kombination von verschiedenen Wachstumsfaktoren zu Nervenzellen. Im Reagenzglas konnten die Neurowissenschaftler deshalb den Nervenzelluntergang, also die Neurodegeneration, erforschen.
Zum anderen setzten sie so genannte Zinkfinger-Nukleasen (ZFN) ein, also kleinste molekulare Scheren, um die Mutation in den erkrankten Zellen zu korrigieren. Wo genau die Schere ansetzt, kann vorher festgelegt werden. Dadurch können bestimmte Gene beziehungsweise Genmutationen, wie G2019S, gezielt korrigiert werden. Die Stabilität des Genoms wird dadurch nicht gefährdet. Die Studienautoren warnen jedoch gleichzeitig vor zu voreiliger Euphorie: „Das für die Genkorrektur eingesetzte, noch junge Verfahren wurde bisher nur im Reagenzglas getestet. Ob wir diese Technik oder diese Zellen auch am Patienten einsetzen können müssen weitere Studien zeigen.“
Absterbenden Nervenzellen auf der Spur
Die Hirnforscher verglichen die Gen-korrigierten Nervenzellen mit gesunden Zellen: Die Untersuchung belegte, dass die Korrektur der Mutation erfolgreich war. Denn die Neuronen waren „gesund“. Sie zeigten somit keine Anzeichen des für Parkinson typischen Zelluntergangs. Die „kranken“ Nervenzellen hingegen verhielten sich im Reagenzglas wie im Gehirn eines Patienten. Sie waren empfindlicher und starben schneller ab. „Außerdem waren ihre Fortsätze verkürzt und reicherten fehlgefaltete Proteine an, die auch bei Parkinson-Patienten in diesen Neuronen angehäuft werden“, sagt Diplom Biochemiker Benjamin Schmid, sagt Diplom Biochemiker Benjamin Schmid, Mitarbeiter am Hertie Institut für klinische Hirnforschung (HIH) der Universität Tübingen sowie des DZNE-Standorts Tübingen. In gesunden Zellen sorgen besondere Eiweißkomplexe fu?r die korrekte Faltung von Proteinen.
Zusätzlich entdeckte die Forschergruppe eine von der G2019S-Mutation „überaktivierte“ Proteinkaskade – und zwar die extrazellulär regulierte Kinase Signalkaskade (ERK1/2)“. Diese Kaskade ist Teil eines komplexen molekularen Regel- und Signalmechanismus, der die Kommunikation von Zellen regelt. Dazu gehört auch die Apoptose, also eine Form des programmierten Zelltods. „Bei Parkinson trägt die Überaktivierung dieser Proteinkaskade zum Absterben der Nervenzellen bei“, beschreibt Diplom Biochemiker Peter Reinhard, Max-Planck-Institut für molekulare Biomedizin, Münster, den durch die Mutation ausgelösten Effekt. Die Fehlfunktion derartiger Kaskaden beeinflusse auch, so die Hirnforscher, zahlreiche weitere neurodegenerative Erkrankungen. Die Gabe bestimmter Medikamenten, sogenannter Kinase-Inhibitoren, die bereits teilweise in der Krebstherapie eingesetzt werden, ‚normalisieren‚ den Prozess und erhöhen die Überlebenschancen der Zellen. „Erst durch die Entdeckung neuer krankheitsrelevanter molekularer Signalwege gelingt es uns, neue Wege, die für das Verständnis von Morbus Parkinson sowie für die Suche neuer gezielter Therapieansätze wichtig sind, zu beschreiten“, so Sterneckert.