Gezinkte Gegenwehr im Kampf gegen Krankheitserreger
Forscher klären die Struktur und Funktion eines wichtigen körpereigenen Antibiotikums auf
Antibiotika gibt es nicht nur auf Rezept. Auch unser eigener Körper produziert wirksame Substanzen, um Bakterien, Pilze und Viren in Schach zu halten. Ein internationales Forscherteam aus Göttingen, Tübingen, Edinburgh und Strasbourg hat jetzt die Struktur eines wichtigen körpereigenen Antibiotikums namens Dermcidin Atom für Atom aufgeklärt. Zu einer hochwirksamen Waffe im Kampf gegen Tuberkulose-Erreger und andere gefährliche Angreifer machen es seine besonderen Eigenschaften, haben die Wissenschaftler herausgefunden. Ihre Erkenntnisse könnten dazu beitragen, neue Antibiotika zu entwickeln, die auch multiresistente Bakterien erfolgreich bekämpfen.
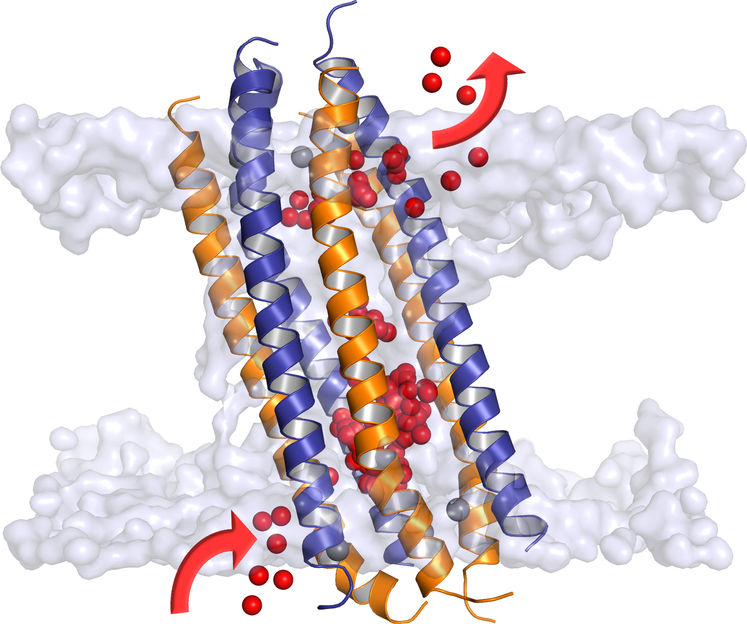
Das aktive Dermcidin ist ein Kanalprotein mit außergewöhnlich hoher Ionendurchlässigkeit und Anpassungsfähigkeit. Diese Eigenschaften machen es zu einem wirkungsvollen Breitbandantibiotikum.
© de Groot / Max-Planck-Institut für biophysikalische Chemie
Wenn uns der Schweiß ausbricht, hat das sein Gutes. Er verteilt dabei hochwirksame Antibiotika auf der Haut, die uns vor Krankheitserregern schützen. Wird unsere Haut durch einen Kratzer, einen Schnitt oder einen Mückenstich verletzt, töten in den Schweißdrüsen produzierte Wirkstoffe wie Dermcidin gefährliche Eindringlinge schnell und wirksam ab. Solche sogenannten antimikrobiellen Peptide (AMPs) sind gängigen Antibiotika in einem wichtigen Punkt sogar weit überlegen. Krankheitserreger können nicht innerhalb kurzer Zeit resistent dagegen werden. Die Resistenzbildung verhindern AMPs wirkungsvoll, indem sie gezielt die Achillesferse der pathogenen Angreifer attackieren: Sie durchlöchern ihre lebenswichtige Hüllmembran und diese können die Erreger nicht ohne Weiteres verändern. AMPs bergen daher großes Potenzial für eine neue Generation von Antibiotika.
1700 körpereigene AMPs bekannt
„Doch um solche Wirkstoffe maßzuschneidern, müssen wir zunächst im Detail verstehen, wie körpereigene Antibiotika die Krankheitserreger erfolgreich mattsetzen. Obwohl bisher 1700 solcher Peptide entdeckt wurden, wissen wir nur sehr wenig über ihre Form und Funktion“, betont Bert de Groot, Leiter der Forschungsgruppe „Computergestützte biomolekulare Dynamik“ am Max-Planck-Institut für biophysikalische Chemie in Göttingen. Gemeinsam mit Kollegen aus Edinburgh (Großbritannien), Tübingen, Strasbourg (Frankreich) und Göttingen hat er jetzt erstmals in atomarem Detail aufgeklärt, was Dermcidin zu einer wahren Wunderwaffe im Kampf gegen gefährliche Erreger macht.
Wissenschaftler wissen seit längerem, dass Dermcidin im sauer-salzigen Schweiß gespalten und dadurch aktiviert wird. Das aktive Dermcidin-Peptid bildet dann, stabilisiert durch die im Schweiß vorkommenden Zinkionen, winzige Kanäle durch die Hüllmembran der Krankheitserreger und durchlöchert sie quasi. In der Folge strömen Wasser und Ionen unkontrolliert durch die Hüllmembran. Wasserhaushalt und Transportvorgänge der Mikroorganismen geraten außer Kontrolle, sie sterben langsam ab.
Dermcidin attackiert Achillesferse der Angreifer
Durch den kombinierten Einsatz der Röntgenkristallografie und der Festkörper-NMR-Spektroskopie konnten Forscher um Kornelius Zeth am Max-Planck-Institut für Entwicklungsbiologie in Tübingen und Burkhard Bechinger an der Universität Strasbourg jetzt Atom für Atom aufklären, wie dieser Kanal aufgebaut ist. Wie sie herausfanden, ist er außergewöhnlich lang, durchlässig und anpassungsfähig. Er bildet damit eine völlig neue Klasse von Membranproteinen.
Mithilfe aufwendiger Computersimulationen schaute das Team um Bert de Groot dem aktiven Dermcidin gewissermaßen „bei seiner Arbeit“ zu. Zur Überraschung der Göttinger Forscher durchquerten die Ionen den Kanal auf ganz ungewöhnliche Weise. Der Chemiker Ulrich Zachariae erklärt: „Man sieht bei unseren Simulationen sehr schön, dass der Kanal schief in der Membran sitzt. Dadurch nutzen Ionen auch den ‚Seiteneingang’. So können mehr Ionen gleichzeitig den Kanal durchqueren.“ Die Simulationen liefern damit eine Erklärung für die hohe Ionendurchlässigkeit des Kanals, die Claudia Steinem von der Universität Göttingen in elektrophysiologischen Experimenten messen konnte. Steinems Ergebnisse zeigen auch: Ohne Zinkionen versagt die Wunderwaffe ihren Dienst. Nur wenn Zinkionen und Dermcidin miteinander wechselwirken, bilden sich in der Membranhülle funktionsfähige Kanäle. Verhinderten Wissenschaftler diese Wechselwirkung durch Mutation eines bestimmten Bausteins im Dermcidin (einem sogenannten Histidin-Aminosäurerest), bildete sich kein ionendurchlässiger Kanal.
Potenzial für eine neue Klasse von Antibiotika
Dermcidin kann sich zudem äußerst wandelbar verschiedenen Membrantypen anpassen. „Dies könnte erklären, warum das aktive Dermcidin ein solch effizientes Breitband-Antibiotikum ist und Bakterien wie Pilze gleichermaßen bekämpfen kann. Es wirkt gegen viele bekannte Krankheitserreger wie den Tuberkulose-Erreger Mycobacterium tuberculosis oder Staphylococcus aureus“, erläutert de Groot. Insbesondere multiresistente Stämme von Staphylococcus aureus werden zu einer wachsenden Gefahr in Krankenhäusern. Sie sind gegen die gängigen Antibiotika unempfindlich und deshalb nur schwer zu behandeln. Laut Robert-Koch-Institut waren 1976 gerade einmal zwei Prozent der Staphylococcus-Bakterien gegen Antibiotika resistent. Bis 2009 stieg der Anteil auf knapp 22 Prozent. Infektionen mit diesem Krankheitserreger können zu lebensbedrohenden Erkrankungen wie Blutvergiftung und Lungenentzündung führen. Das internationale Forscherteam hofft, dass sich mit ihren Erkenntnissen eine neue Klasse von Antibiotika entwickeln lässt, mit der sich solch gefährliche Krankheitserreger erfolgreich bekämpfen lassen.