Einblick in die Schaltzentralen der Zellkommunikation
Forscher entdecken charakteristische Baumerkmale in einer Familie von Sensoren, die im menschlichen Körper Signale verarbeiten und physiologische Prozesse steuern
Die Zellen im menschlichen Körper kommunizieren unablässig miteinander, um ihre unterschiedlichen Aufgaben koordiniert zu erfüllen. Sie verfügen dazu über Sensoren, mit denen sie Signale aus ihrer Umwelt empfangen können. Sensoren auf der Oberfläche von Zellen werden Rezeptoren genannt. Zahlreiche Prozesse in unserem Körper wie das Sehen, Riechen oder Schmecken werden durch eine wichtige Familie von Rezeptoren bewerkstelligt, die man G-Protein-gekoppelte Rezeptoren (GPCR) nennt. Dazu gehören auch Rezeptoren, die Gefühlszustände steuern und für die Angst- und Stressreaktion mitverantwortlich sind. Forscher des Paul Scherrer Instituts haben nun zusammen mit Kollegen aus Grossbritannien die bislang bekannten räumlichen Strukturen von GPCR analysiert und miteinander verglichen. So haben sie ein stabilisierendes Gerüst von feinen Verstrebungen entdeckt, das in allen Rezeptoren vorkommt und daher charakteristisch ist für die Architektur der gesamten GPCR-Familie. Zudem haben sie in den Bindungstaschen dieser Rezeptoren einen Universalstecker für andockende Moleküle gefunden. Das Wissen um diese im Lauf der Evolution konservierten Baumerkmale kann für die Entwicklung neuer Medikamente von erheblichem Nutzen sein.
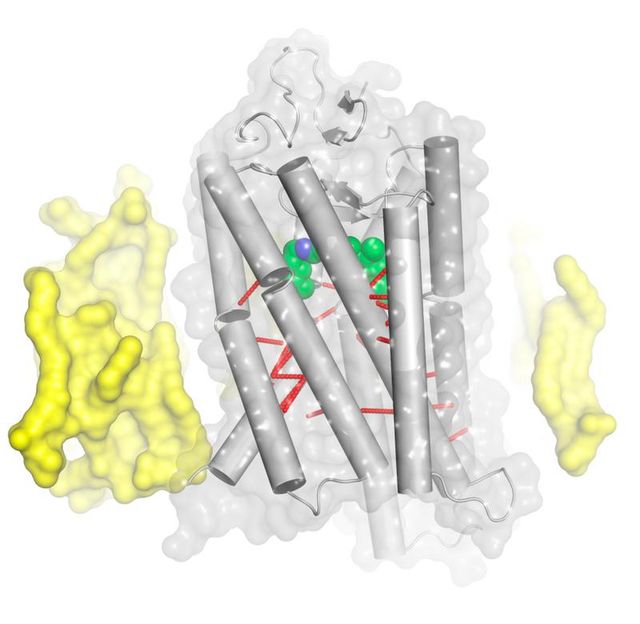
Schematische Darstellung eines GPC-Rezeptors am Beispiel des Lichtrezeptors Rhodopsin. Im Inneren ist der Ligand (in grün) zu sehen. Die roten Verstrebungen deuten die stabilisierenden Kontakte zwischen den Molekülstangen an, die für den Bau der GPCR-Familie charakteristisch sind. Die Zellmembran ist gelb eingefärbt. Der Teil im Bild oben ist ausserhalb der Zelle, der Teil unten ist innerhalb.
Paul Scherrer Institut/X. Deupi
Rezeptoren sind komplexe Biomoleküle aus Proteinen, die in der Aussenhaut der Zelle, der Zellmembran, eingelagert sind. Sie bestehen aus tausenden von Atomen und haben eine definierte räumliche Struktur, die ihre Funktion bestimmt. Als eigentliche Schaltzentralen der Zellkommunikation erkennen sie Reize oder Botenstoffe, die von aussen an die Zelle gelangen, und übertragen die Information über das angekommene Signal ins Zellinnere. Die Familie der G-Protein-gekoppelten Rezeptoren (GPCR) umfasst rund 800 verwandte Sensoren, die im Körper unterschiedlichste Aufgaben übernehmen: Sie verarbeiten Licht-, Geruchs- und Geschmacksreize, vermitteln die Wirkung zahlreicher Hormone, darunter Adrenalin und Histamin, und erkennen Hirnbotenstoffe wie Dopamin oder Serotonin.
Bindet ein Botenstoff an den für ihn bestimmten GPCR, wird das Biomolekül aktiviert. Dadurch verändert sich seine Form derart, dass auf der Innenseite der Membran ein so genanntes G-Proteinmolekül andocken kann. Die Bindung des G-Proteins an den Rezeptor löst eine Reihe von biochemischen Vorgängen aus, die je nach Zelltyp zu unterschiedlichen Antworten führen.
Molekulare Signatur der GPCR-Familie
In den letzten 20 Jahren hat die Strukturbestimmung im Bereich der GPCR enorme Fortschritte gemacht, so dass heute die detaillierte Bauweise von 17 wichtigen Rezeptoren dieser Familie geklärt ist. GPCR bestehen generell aus insgesamt sieben aneinandergehängten, stangenförmigen Molekülteilen, die von aussen ins Innere der Zelle hineinreichen. Innerhalb dieses Gebildes sorgen feine elektrostatische Kräfte dafür, dass sich zwischen räumlich benachbarten Molekülstangen Kontakte ausbilden, die die Nanomaschine zusammenhalten.
Forscher des Paul Scherrer Instituts und des MRC Laboratory of Molecular Biology in Cambridge ist es nun gelungen, die bekannten Rezeptorstrukturen auf atomarer Ebene zu vermessen und für jede der Komponenten die exakten Positionen der Kontakte zu ermitteln, die zwischen den einzelnen Molekülstangen ausgebildet sind. Anschliessend haben die Wissenschaftler die gewonnenen Daten systematisch verglichen und konnten 24 gemeinsame Kontakte identifizieren, die in allen untersuchten Rezeptorstrukturen vorkommen und stets zwischen denselben Schlüsselpositionen im Molekül ausgebildet sind. «Man kann sich diese Kontakte als ein Gerüst von feinen Verstrebungen vorstellen, das im Lauf der Evolution konserviert wurde und charakteristisch ist für die Architektur der gesamten GPCR-Familie», erklärt Xavier Deupi, Strukturbiologe am Labor für Biomolekulare Forschung des PSI.
Die Forscher entdeckten auch Ähnlichkeiten in den Bindungstaschen verschiedener GPCR. Hier allerdings fokussierten sie sich auf Kontakte zwischen den Rezeptoren und ihren gebundenen Liganden, also den Signalmolekülen, die in der Bindungstasche andocken. «Die Bindungstaschen verschiedener Rezeptoren unterscheiden sich zwar stark je nach Grösse und Form der Liganden. Dennoch konnten wir tief am Boden der Tasche eine Art Universalstecker identifizieren. Der Stecker umfasst vier Stellen im Protein, die zusammen stets vier Kontakte zum Liganden bilden – unabhängig davon, wie der Ligand im Einzelfall beschaffen ist», erläutert Deupi. Da der Universalstecker in allen Rezeptoren erhalten ist, gehen die Wissenschaftler davon aus, dass dieser Bereich der Bindungstasche eine entscheidende Rolle bei der Aktivierung der GPCR spielt.
Vergleichende Analyse von Proteinstrukturen
Für ihre Untersuchungen haben die Forscher ein Verfahren entwickelt, das es erlaubt, die Information über die räumliche Struktur von Proteinen auf das Muster der Kontakte innerhalb der Moleküle zu reduzieren. Um die gewonnen Muster vergleichen zu können, verwendeten sie die Methode der Netzwerkanalyse, die Bioinformatikern für gewöhnlich dazu dient, Interaktionen in biologischen Netzwerken zu studieren. «Dieser Ansatz erlaubt es uns erstmals, verwandte Rezeptorstrukturen unbefangen zu betrachten und Ähnlichkeiten herauszufiltern. Natürlich kamen dabei Kontakte heraus, die bereits bekannt waren. Damit konnten wir die Methode validieren. Die verbleibenden Kontakte, weit mehr als die Hälfte, haben wir effektiv neu entdeckt, darunter auch die Kontakte zwischen Universalstecker und Liganden», sagt Gebhard Schertler, Leiter des Forschungsbereichs Biologie und Chemie am PSI.
Ansatzpunkt für die Entwicklung neuer Medikamente
GPCR sind bei etlichen Prozessen im Körper involviert. Sie agieren als Lichtsensoren in unseren Augen, ermöglichen uns das Riechen und Schmecken, steuern Angst- und Stressreaktionen und regulieren unsere Gefühlszustände. Deshalb ist die GPCR-Familie von grossem Interesse für die pharmazeutische Forschung. «Die bessere Kenntnis der Rezeptorstrukturen und das Wissen um die gemeinsamen Baucharakteristiken trägt einerseits zu einem besseren Verständnis fundamentaler Lebensvorgänge bei. Andererseits bilden die Ergebnisse auch die Grundlage für die Computer-gestützte Entwicklung neuer Wirkstoffe. Unsere Resultate können etwa helfen, bessere Modelle von GPCR zu erstellen – auch von solchen, deren räumliche Struktur noch gar nicht im Detail geklärt ist», erklärt Deupi.
Rund die Hälfte aller heute verfügbaren Medikamente wirken, indem sie an GPC-Rezeptoren binden und deren Aktivität beeinflussen. Bekannte Beispiele sind die als Beta-Blocker geläufigen Blutdruckmittel, entzündungshemmende Wirkstoffe wie Anti-Histaminika, verschiedene Psychopharmaka und Migränemittel.