Positionsbestimmung von Muskelproteinen
Max-Planck-Wissenschaftler beobachten Grundlage der Muskelbewegung mit bislang unerreichter Schärfe
Muskelkontraktion und viele andere Bewegungsprozesse werden durch das Zusammenspiel zwischen Myosin- und Aktinfilamenten gesteuert. Zwei weitere Proteine, Tropomyosin und Troponin regulieren die Bindung des Myosins an Aktin. Wie genau diese Muskelproteine interagieren, ist zwar in theoretischen Modellen beschrieben, allerdings bisher nie im Detail beobachtet worden. Stefan Raunser und Elmar Behrmann vom Max-Planck-Institut für molekulare Physiologie in Dortmund ist es nun gelungen, den Aktin-Myosin-Tropomyosin-Komplex mit bisher unerreichter Genauigkeit von 0.8 Nanometern sichtbar zu machen - was einer Auflösung von weniger als einem Millionstel Millimeter entspricht. Dies ermöglicht es erstmals, die Proteine innerhalb des Komplexes korrekt zu positionieren und die Vorgänge bei der Muskelkontraktion zu analysieren. Mit diesen Erkenntnissen könnte aufgeklärt werden, wie sich genetisch bedingte Veränderungen des Aktin-Myosin-Tropomyosin-Komplexes auf manche vererbbare Herzerkrankungen auswirken.
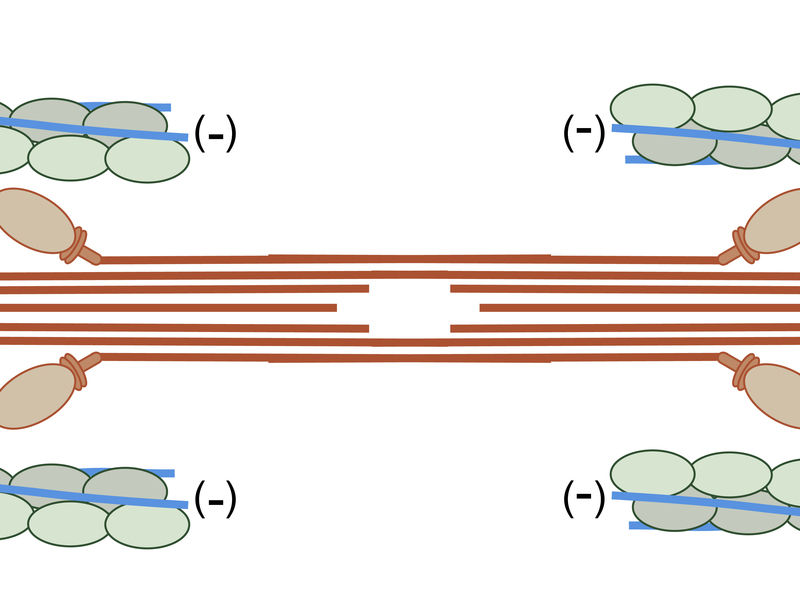
Schematische Zeichnung des Sarkomers. Die Z-Scheibe ist in schwarz dargestellt, Aktin in grün/grau , Tropomyosin in blau und Myosin in rot.
© MPI of Molecular Plant Physiology
Die zentrale funktionelle Einheit, das Sarkomer, eines Muskels besteht aus Aktin-, Myosin- und Tropomyosin-Proteinen. Damit sich ein Muskel zusammenziehen kann, muss das Myosin an den fadenförmigen Aktinmolekülen entlang gleiten. Zusammen mit Troponin reguliert Tropomyosin die Muskelkontraktion, indem es steuert wann Myosin an Aktin gebunden ist. Im Ruhezustand blockieren Tropomyosin und Troponin die Bindungsstelle für Myosin am Aktinfilament. Der Myosinkopf befindet sich dann in 90 Grad Stellung. Erst durch einströmendes Calcium, das an die Regulationsproteine andockt, wird die Bindungsstelle am Aktinfilament frei gelegt. Der Myosinkopf dockt an diese an, ändert seine Konformation und knickt gelenkartig ab, wobei er das Aktin mit sich zieht. Das aneinander Vorbeigleiten der Filamente führt zu einer Verkürzung des Sarkomers und somit zum Zusammenziehen des Muskels.
Die diesem Modell zugrundeliegende Wechselwirkung zwischen Aktin, Myosin und Tropomyosin konnten Wissenschaftler des Max-Planck-Instituts für molekulare Physiologie in Zusammenarbeit mit Wissenschaftlern der Medizinischen Hochschule Hannover, der Ruhr-Uni Bochum und der University of Texas in Houston, nun erstmals im Detail zeigen. Dank der verbesserten technischen Möglichkeiten im Bereich der Elektronenmikroskopie erhalten Stefan Raunser und seine Kollegen erstmals einen genauen Einblick in die strukturellen Elemente des Muskels. „Ein wichtiger Schritt um das Zusammenspiel der einzelnen Proteine innerhalb der funktionellen Strukturen des Muskels zu verstehen“, sagt Raunser.
So bestimmten sie beispielsweise die genaue Position von Tropomyosin auf dem Aktin-Filament im Myosin-gebundenen Zustand und zeigten durch die im Detail sichtbar gemachte Struktur des Komplexes, dass Aktin tatsächlich Konformationsänderungen in Myosin bewirkt. Vergleiche mit Moysinstrukturen in anderen Zuständen ermöglichen es den Forschern, das Zusammenspiel von Myosin und Aktin während der Muskelkontraktion zu beschreiben. „Wir haben so etwas wie eine Landkarte für Biochemiker gebastelt. Für sie wird es durch unsere Ergebnisse künftig leichter Prozesse und Abläufe innerhalb der Muskulatur zu verstehen“, so Raunser.
Darüber hinaus sind die Ergebnisse aus medizinischer Sicht von hoher Relevanz. Das menschliche Herz ist der wichtigste Muskel im menschlichen Körper, funktioniert er nicht optimal, so kann dies zum Tod führen. Fehlfunktionen innerhalb des Herzens hängen oft mit Punktmutationen zusammen. Die Aufnahmen der Max-Planck-Forscher ermöglichen nun erstmals diese Mutationen genau zu positionieren. „Die genaue Position der Mutationen zu erkennen ist eine Grundvoraussetzung um Therapien für solche Herzerkrankungen zu entwickeln“, sagt Stefan Raunser.
Originalveröffentlichung
Behrmann, Müller, Penczek, Mannherz, Manstein und Raunser; Structure of the Rigor Actin-Tropomyosin-Myosin Complex; Cell,20 July 2012





















































