Diabetes-Medikament hemmt gefährliche Entzündung des Fettgewebes
Das Bauchfettgewebe von Übergewichtigen ist chronisch entzündet – dies gilt als eine der Hauptursachen für die Entwicklung eines Diabetes vom Typ 2. Bei normalgewichtigen Mäusen hält eine spezifische Gruppe von Immunzellen diese Entzündungen in Schach. Wissenschaftler aus dem Deutschen Krebsforschungszentrum und der Harvard Medical School veröffentlichten nun in Nature, dass sich diese Immunzellen mit einem Diabetes-Medikament aktivieren und im Fettgewebe anreichern lassen. Die aktivierten Immunzellen drosseln nicht nur die gefährliche Entzündung, sondern sorgen auch dafür, dass sich der Zuckerstoffwechsel normalisiert.
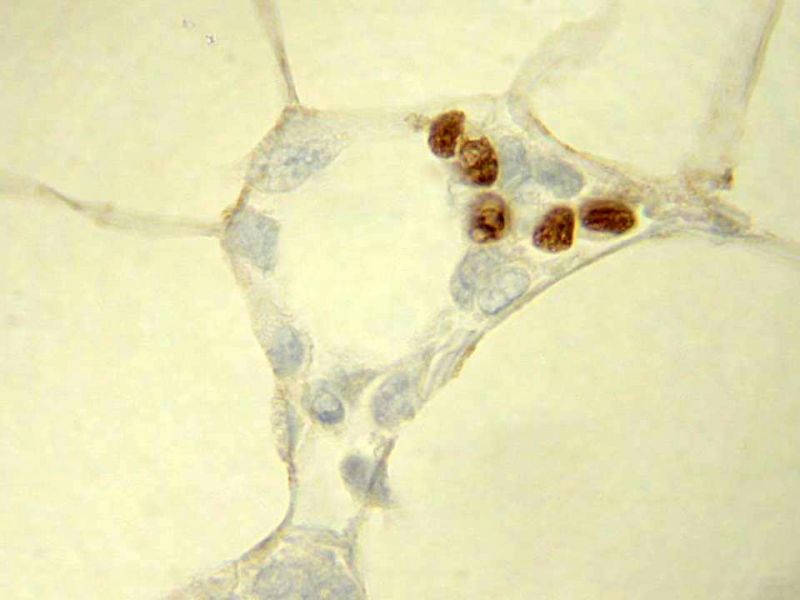
Schnitt durch das Bauchfettgewebe einer Maus. Braun eingefärbt sind die Kerne der entzündungshemmenden regulatorischen T-Zellen.
© dkfz.de
Bei Menschen wie bei Mäusen gilt: Das Bauchfettgewebe stark übergewichtiger Individuen ist chronisch entzündet. Die Entzündung fördert Insulinresistenz, Typ-2-Diabetes und gilt als einer der Faktoren, die das Krebsrisiko fettleibiger Menschen steigern.
Ursache der Entzündung sind Makrophagen, die in großer Zahl in das Bauchfettgewebe einwandern. Dort schütten sie Botenstoffe aus, die die entzündlichen Vorgänge weiter anheizen. Dr. Markus Feuerer vom Deutsches Krebsforschungszentrum, der bis vor kurzem an der Harvard Medical School forschte, machte dort eine aufsehenerregende Entdeckung: Er fand im Bauchfettgewebe normalgewichtiger Mäuse eine Gruppe von spezialisierten Immunzellen, so genannte regulatorische T-Zellen, die die Entzündung in Schach halten. Im Bauchfett von fettleibigen Mäusen war jedoch genau diese Zellpopulation stark reduziert. „Mit experimentellen Methoden konnten wir diese entzündungshemmenden T-Zellen in fettleibigen Mäusen vermehren. Daraufhin ging die Entzündung zurück und der Zuckerstoffwechsel normalisierte sich“, sagt Feuerer.
In seiner neuen Arbeit entdeckte Markus Feuerer gemeinsam mit seinen ehemaligen Kollegen aus der Gruppe von Diane Mathis an der Harvard Medical School das Zellkern-Protein PPARγ als molekularen Hauptschalter, der die fett-spezifische Aktivität dieser regulatorischen T-Zellen steuert. Die Immunologen züchteten Mäuse, deren regulatorische T-Zellen kein PPARγ produzieren können. Im Bauchfett dieser Tiere fanden sich kaum noch entzündungshemmende T-Zellen, dafür aber deutlich mehr entzündungsfördernde Makrophagen als bei normalen Artgenossen.
PPARγ ist Medizinern gut bekannt als Zielmolekül einer Klasse von Diabetes-Medikamenten: Die Glitazone, auch bezeichnet als „Insulin-Sensitizer“, aktivieren dieses Rezeptormolekül im Zellkern. Bislang waren Ärzte davon ausgegangen, dass die Glitazone den Zuckerstoffwechsel hauptsächlich dadurch verbessern, dass sie PPARγ in den Fettzellen aktivieren. Die Immunologen testeten daher zunächst, ob die Medikamente auch direkt auf die entzündungshemmenden Immunzellen wirken. Dies scheint der Fall zu sein, denn nach Glitazone-Behandlung stieg bei fettleibigen Mäusen die Anzahl entzündungshemmender Zellen spezifisch im Bauchfett, zugleich sank die Zahl entzündungsfördernder Makrophagen.
Hat die Wirkung auf die entzündungshemmenden T-Zellen möglicherweise sogar Anteil am therapeutischen Effekt der Medikamente? Die Ergebnisse sprechen dafür: Bei fettleibigen Mäusen verbesserte die Glitazone-Behandlung Stoffwechsel-Parameter wie Glukosetoleranz und Insulinresistenz. Bei den genetisch veränderten Tieren, deren regulatorische T-Zellen kein PPARγ produzieren können, normalisierte das Medikament den Zuckerstoffwechsel jedoch nicht.
„Das ist eine völlig unerwartete Wirkung dieser bekannten Medikamentengruppe“, sagt Feuerer. Erste Studien deuten darauf hin, dass es auch im Bauchfett des Menschen eine spezifische Population regulatorischer T-Zellen gibt. „Wir müssen aber noch prüfen, ob diese Zellen tatsächlich die Entzündungen des Fettgewebes drosseln und ob wir sie auch durch Glitazone beeinflussen können“, erklärt der DKFZ-Immunologe. „Ein ganz wichtiges Ergebnis unserer aktuellen Arbeit ist darüber hinaus, dass wir erstmalig gezielt eine bestimmte Population der regulatorischen T-Zellen, organspezifisch, mit einem Wirkstoff ansprechen können. Das eröffnet Perspektiven für die Behandlung vieler Krankheiten“.
Die chronische Entzündung des Fettgewebes gilt auch als Wachstumstreiber für viele Krebserkrankungen. Deshalb interessieren sich auch Krebsforscher für die Möglichkeit, solche Entzündungen mit einem Medikament einzudämmen zu können.



























































