Zusammenspiel hauptverdächtiger Moleküle bei der Alzheimer-Erkrankung geklärt
Nervenschädigung wird von Pyroglutamat Abeta (Aβ) ausgelöst und ist abhängig vom tau-Protein
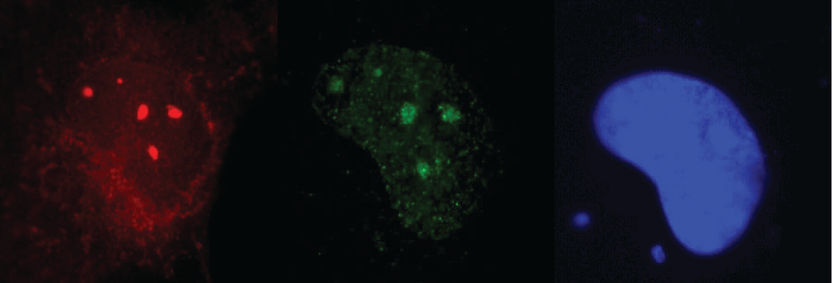
Pyroglutamat Aβ ("pyroGluAβ") ist ein giftiges Proteinfragment der sogenannten Aβ-Peptidablagerungen im Gehirn von Alzheimer-Patienten. Es führt zur Bildung von sogenannten niedermolekularen Oligomeren (LMO), noch stärker giftigen Zusammenlagerungen, die sich ähnlich wie Prionen entlang der Nervenbahnen ausbreiten und den Untergang der Neuronen einleiten. Beteiligt daran ist ein tau-Protein-abhängiger Mechanismus. Dies erklärt die entscheidende Rolle der modifizierten Aβ-Oligomere für die Entstehung und Ausbreitung neuronaler Toxizität bei der Alzheimer-Krankheit.
Probiodrug AG gab die Publikation von wegweisenden Erkenntnissen zur Rolle von pyroGluAβ bei der Pathologie der Alzheimerschen Demenz (AD) bekannt. Die neuen Erkenntnisse sind ein weiterer Beleg für die These, dass pyroGluAβ Peptide eine entscheidende Rolle bei der Initiierung der Krankheit spielen. Darüber hinaus zeigen die Forschungsergebnisse auf, durch welche Mechanismen pyroGluAβ die neuronale Toxizität auslöst.
Die neuen Daten belegen, dass pyroGluAβ Mischaggregate mit "normalen" Aβ Peptiden bildet. Diese gemischten Oligomere mit niedrigem Molekulargewicht (kurz LMO genannt) unterscheiden sich von denen, die nur aus "normalem" Aβ bestehen, durch ihre Struktur, ihre Giftigkeit für Nervenzellen und ihre hohe Lebensdauer von normalen LMOs. Darüber hinaus ist die Anwesenheit des neuronalen Proteins tau für die Vermittlung der Zellgiftigkeit durch die pyroGluAβ-haltigen bzw. induzierten LMOs verantwortlich.
Diese zellbiologischen Ergebnisse wurden in transgenen Mäusen bestätigt, die pyroGluAβ nur in relativ geringen Mengen erzeugen, dort aber eine fatale AD-Symptomatik auslösen. Bei diesen Tieren allerdings konnten der durch die pyroGluAβ Peptide ausgelöste starke Neuronenverlust ebenso wie die massive Nervenentzündung verhindert werden, wenn die Bildung von tau-Protein durch die sogenannte Knock-out-Technologie unterdrückt wurde. Ergänzt werden diese Ergebnisse durch eine weitere aktuelle Studie im Journal of Neurochemistry (online-Veröffentlichung April 2012). Darin konnten die Probiodrug-Forscher nachweisen, dass die Aggregationsneigung und LMO-Bildung durch die besonders hydrophobe Natur der pyroGluAβ Peptide verursacht wird.
Gemeinsam mit akademischen Partnern aus österreichischen, deutschen und amerikanischen Forschungseinrichtungen konnten die halleschen Wissenschaftler zeigen, dass die Zellgiftigkeit durch Ausbildung einer speziellen Struktur der pyroGluAβ-Oligomere eingeleitet wird. Durch einen infektiösen Mechanismus, der dem Ausbreitungsmechanismus der Prion-Proteine ähnelt, werden die durch Kontakt mit pyroGluAβ erworbende Struktur und die damit verbundenen neurotoxischen Eigenschaften an weitere, normale Aβ-Peptide weitergegeben. Auch nach mehrfacher Verdünnung einer Aβ-Mischung durch frisches, "normales" Aβ zu einer Lösung, die am Ende nur noch 0.000625% pyroGluAβ enthält, entwickeln die neuen, gemischten Oligomere nach 24 Stunden noch genügend Toxizität, um 50% der Neuronen, die mit ihnen behandelt wurden, zu vernichten.
"Diese Veröffentlichung liefert signifikante Belege für unsere Hypothese, dass pyroGluAβ Peptide eine wichtige oder sogar die entscheidende Rolle bei der Auslösung des Nervenzellverlustes spielen, den wir bei der Alzheimerschen Demenz beobachten", sagte Prof. Dr. Hans-Ulrich Demuth, Forschungsvorstand der Probiodrug AG. „Es war sehr überraschend für uns, dass nur die pyroGluAβ-haltigen bzw. durch pyroGluAβ-induzierten, gemischten niedermolekularen Oligomere für Tage stabil bleiben. Die neuen Daten belegen erstmalig eine Beziehung zwischen pyroGluAβ, der Bildung giftiger Aβ-Oligomere und dem tau-Protein bei der Entwicklung neuronaler Toxizität."
Dr. Konrad Glund, Vorstandssprecher von Probiodrug, ergänzte: "Dies ist ein bedeutender Schritt nach vorn für unser Verständnis der molekularen Krankheitsmechanismen. Darüber hinaus unterstützen diese Ergebnisse Probiodrugs therapeutischen Ansatz, das Enzym Glutaminyl Zyklase (QC), das für die Bildung von pyroGluAβ verantwortlich ist, mit niedermolekularen Inhibitoren zu blockieren, um so die Alzheimerschen Demenz zu behandeln. Ein entsprechender Wirkstoffkandidat, PQ912, ist gerade in Phase 1-Studien erfolgreich geprüft worden. Das Unternehmen bereitet nun erste Patienten-Studien vor. "