Kristallstruktur des Immunoproteasoms aufgeklärt
Grundlage für die Entwicklung neuer Medikamente gegen Autoimmunerkrankungen
Ähnlich einem „Schredder“ zerlegt das Immunoproteasom Eiweiße in kleine Bruchstücke, die dann an der Oberfläche der Zelle präsentiert werden. Werden diese Eiweißteile als „körperfremd“ erkannt, vernichtet das Immunsystem die Zelle. Bei Autoimmunerkrankungen ist dieser Prozess gestört. Helfen könnte dagegen, das Immunoproteasom zu hemmen. Biochemikern der Technischen Universität München (TUM) gelang es nun erstmals, die Kristallstruktur des Immunoproteasoms aufzuklären und Angriffsstellen für neue Medikamente aufzuzeigen.
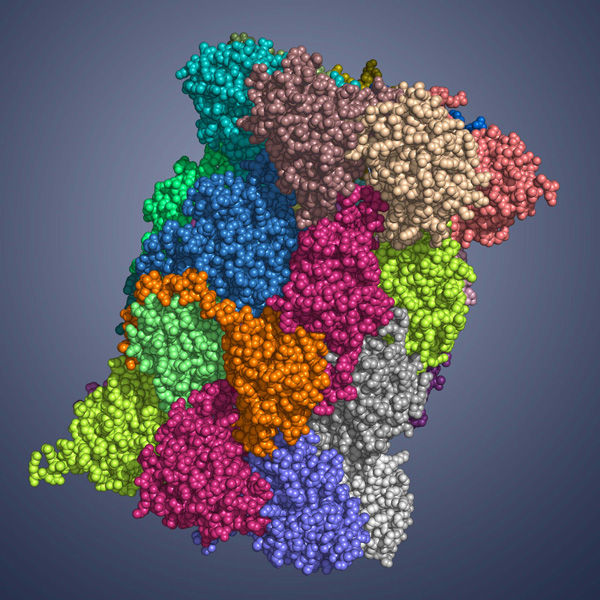
Immunoproteasom
TU München
Das Proteasom, ein großer, zylinderförmiger Eiweißkomplex, spielt in den Zellen des Körpers eine lebenswichtige Rolle. Ähnlich einer Recyclinganlage zerlegt es nicht mehr benötigte Proteine in kleinere Stücke, so dass diese wiederverwertet werden können. Auf diese Weise steuert das Proteasom essentielle Funktionen der Zelle: Es reguliert Zellwachstum sowie Zellteilung und baut überflüssige oder defekte Proteine ab.
Eine spezialisierte Form des Proteasoms, die es nur in höheren Lebewesen wie Säugern gibt, ist das Immunoproteasom. Es unterscheidet sich vom normalen, so genannten „konstitutiven“ Proteasom in den enzymatisch aktiven Untereinheiten. Als wichtiger Partner des Immunsystems schneidet das Immunoproteasom die Proteine so, dass die Eiweißbruchstücke gut an den MHC-I Rezeptorkomplex binden können. Dieser bringt die Eiweißbruchstücke als sogenannte „Antigene“ an die Zelloberfläche und präsentiert sie dort. Handelt es sich dabei um ein Fragment eines körperfremden Eiweißes – etwa von einem zuvor eingedrungenen Virus, wird die infizierte Zelle vom Immunsystem vernichtet.
Auf Grund ihrer bedeutenden Rolle für Zellregulation und Immunabwehr stellen die beiden Proteasomtypen einen guten Ansatzpunkt für Medikamente dar. Hemmt man das Proteasom, so begehen beispielsweise Blutkrebszellen Selbstmord. Das erste Medikament, das diese Strategie verfolgt, Bortezomib, erzielt inzwischen einen Umsatz von mehr als 1 Milliarde US-Dollar im Jahr.
Bei manchen Krebsarten sowie bei Autoimmunerkrankungen wie Rheuma, Diabetes Typ I und Multipler Sklerose ist das Gleichgewicht zwischen den beiden Proteasomarten zu Gunsten des Immunoproteasoms verschoben. Blockiert man das Immunoproteasom, kann das korrekte Gleichgewicht wieder hergestellt und die Krankheit behandelt werden. Deshalb suchen Wissenschaftler mit großem Einsatz nach alternativen Wirkstoffen, die spezifisch nur das Immunoproteasom angreifen. Da jedoch dessen atomare Struktur bislang nicht bekannt war, gestaltete sich die Suche sehr schwierig.
Nun gelang Wissenschaftlern um Professor Michael Groll, Inhaber des Lehrstuhls für Biochemie am Department Chemie der TU München und seiner Mitarbeiterin Eva Maria Huber in Zusammenarbeit mit Professor Marcus Groettrup, Inhaber des Lehrstuhls für Immunologie der Uni Konstanz und Leiter des Biotechnologie Instituts Thurgau (BITg) in Kreuzlingen, ein wesentlicher Durchbruch: Mit Hilfe der Röntgenstrukturanalyse bestimmten sie erstmals die Kristallstruktur, und somit den exakten atomaren Aufbau sowohl des Immunoproteasoms als auch des konstitutiven Proteasoms der Maus.
Beide Strukturen bestimmten die Wissenschaftler jeweils ohne und mit einem gebundenen Hemmstoff, dem Wirkstoff PR-957 (ONX 0914). PR-957 ist ein vielversprechender Proteasomhemmer, der spezifisch nur das Immuno- und nicht das konstitutive Proteasom hemmt. Warum der Wirkstoff dies jedoch tut war nicht bekannt – bis jetzt. „Wir konnten nun zum ersten Mal auf atomarer Ebene beobachten, wie und wo der Hemmstoff an beiden Proteasomtypen angreift und so erklären warum er nur das Immunoproteasom blockiert“, erklärt Groll. „Auf dieser Basis können wir nun neue, spezifischere Hemmstoffe entwickeln – das ist ein großer Fortschritt.“
An Hand der Kristallstruktur des Immunoproteasoms konnten die Forscher um Groll und Huber die molekulare Ursache identifizieren, die dafür sorgt, dass PR-957 nur den einen der beiden Proteasomtypen hemmt. Es handelt sich dabei um eine einzige Aminosäure, einen Methioninrest, der sich in einer Tasche des Proteasoms befindet, die für das exakte Zerschneiden der Eiweiße verantwortlich ist. Beide Proteasomtypen besitzen hier fast identische Aminosäuresequenzen. Kleine Unterschiede in der Umgebung des Methionins sorgen jedoch dafür, dass diese Aminosäure im Immunoproteasom anders gedreht ist als im normalen Proteasom. „Dieser geringe Unterschied macht sehr viel aus“, erklärt Eva Maria Huber. „Er vergrößert die Tasche am Immunoproteasom, sodass große Aminosäurereste hinein passen und der Hemmstoff binden kann. Beim konstitutiven Proteasom ist die Tasche kleiner, und der Wirkstoff passt nicht hinein.“
Der feine Unterschied zwischen beiden Proteasomtypen ist ein wichtiger Schritt zur Entwicklung neuer Medikamente gegen Autoimmunerkrankungen. Bei diesen Krankheiten ist das Immunoproteasom zu aktiv, sodass das Immunsystem fälschlicherweise eigenes Gewebe angreift. Mit Hilfe der neuen Erkenntnisse zur genauen Struktur des Immunoproteasoms können Wissenschaftler nun neue Wirkstoffe entwickeln, die das Immunoproteasom gezielt hemmen, ohne das konstitutive Proteasom, das die korrekte Funktion aller Zellen aufrecht erhält, dabei zu stark mit zu beeinflussen.
Die Arbeiten wurden mit Mitteln der Deutschen Forschungsgemeinschaft (SFB595/TP A11), des Bundesministeriums für Bildung und Forschung (ProNet-T3/TP To-03), des Schweizer Nationalfonds (31003A_138451) sowie des Exzellenzclusters Center for Integrated Protein Science Munich (CIPSM) unterstützt. Die Messungen wurden an der PXI- und PXIII-Beamline des Paul Scherrer Instituts (Villigen, Schweiz) durchgeführt.
Originalveröffentlichung
Immuno- and constitutive proteasome crystal structures reveal differences in substrate and inhibitor specificity, Eva M. Huber, Michael Basler, Ricarda Schwab, Wolfgang Heinemeyer, Christopher J. Kirk, Marcus Groettrup, Michael Groll, Cell, 17. Februar 2012