Den Geist in der Flasche halten: Wie Fic-Proteine ihre potenziell tödliche Enzymaktivität regulieren
Anzeigen
Forschende des Biozentrums der Universität Basel haben einen über die gesamte biologische Evolution konservierten regulatorischen Mechanismus aufgeklärt, der die bisher weitgehend unerforschte Enzymfamilie der Fic-Proteine in einen inaktiven Grundzustand zwingt. Die Gruppen von Prof. Christoph Dehio und Prof. Tilman Schirmer konnten zeigen, dass durch die Veränderung einer einzigen Aminosäure diese Hemmung der Enzymaktivität aufgehoben wird. Die in der aktuellen Ausgabe der Fachzeitschrift «Nature» publizierten Ergebnisse erlauben es zukünftig, die potenziell tödliche Funktion der Fic-Proteine in Bakterien und höheren Lebewesen aufzuklären.
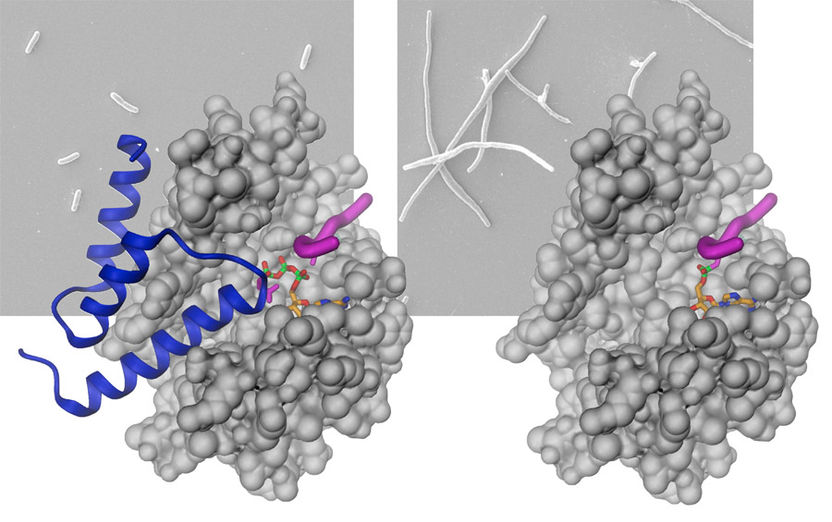
Links: Die Bindung des Antitoxins (blau) an das Fic-Protein (grau) unterbindet die AMPylierung des Zielproteins (magenta) und erlaubt somit normales Wachstum der Bakterien. Rechts: In Abwesenheit des Antitoxins wird das Zielprotein AMPyliert, wodurch die Zellteilung blockiert wird, was zu abnormalem filamentösem Bakterienwachstum führt.
Fic-Proteine kommen in den meisten Lebensformen vom einfachen Bakterium bis zum Menschen vor. Erst wenige Vertreter dieser Proteinfamilie mit etwa 3000 Mitgliedern wurden bisher untersucht. Es handelt sich dabei um Enzyme, die andere Proteine durch das Anheften einer Adenosinmonophosphat-Gruppe (AMP), Teil des wichtigen Energieträgers ATP, chemisch verändern. Diese als AMPylierung bezeichnete Reaktion modifiziert gezielt die Funktion der Zielproteine.
Am besten untersucht ist die Funktion der Fic-Proteine von krankheitserregenden Bakterien, die in die Wirtszelle eingeschleust werden, um dort zelluläre Signalproteine zum Vorteil des Krankheitserregers zu verändern. Die Mehrheit der Fic-Proteine entfaltet aber vermutlich ihre Wirkung unmittelbar in der Zelle, in der sie produziert werden. Warum aber bisher nur für wenige Vertreter dieser Fic-Proteine eine biochemische Funktion nachgewiesen werden konnte, war bisher unverstanden. Den Grund hierfür haben nun die Forschungsgruppen des Infektionsbiologen Prof. Christoph Dehio und des Strukturbiologen Prof. Tilman Schirmer gefunden.
Das Zentrum der Enzymaktivität von Fic-Proteinen ist blockiert Die Forscher konnten zeigen, dass ein Aminosäurerest (Glutamat-Finger) in das aktive Zentrum von Fic-Proteinen hineinragt. Dieser verhindert eine produktive Bindung des ATP und erklärt den inaktiven Grundzustand dieser Enzyme. Erstaunlicherweise ist es dabei unerheblich, ob der hemmende Aminosäurerest Teil des Fic-Proteins selbst oder aber Teil eines separaten Proteins (genannt Antitoxin) ist. Erst wenn dieser Glutamat-Finger durch Veränderung des Erbguts zurechtgestutzt wird oder das ganze Antitoxin entfernt wird, erwacht die Aktivität des Enzyms – mit teilweise drastischen Konsequenzen für die betroffenen Zellen. So stellen bakterielle Zellen das Wachstum ein, während menschliche Zellen sogar sterben können.
Interdisziplinärer Forschungserfolg Dieser Durchbruch gelang den beiden Forschungsgruppen durch die Kombination von Methoden aus der Mikrobiologie, Zellbiologie, Strukturbiologie und Bioinformatik. Atomare räumliche Strukturen von Fic-Proteinen wurden mittels Röntgenkristallografie durch die Schirmer-Gruppe an der Swiss Light Source (Villigen PSI) bestimmt und ließen die detaillierte Geometrie des aktiven Zentrums des Enzyms mit dem hemmenden Glutamat-Finger erkennen. Die Gruppe von Dehio wiederum konnte durch Kombination von Funktionsstudien und Mutagenese die hemmende Rolle dieses Glutamat-Fingers nachweisen und durch umfangreiche Proteinsequenzvergleiche die allgemeine Bedeutung der Entdeckung aufzeigen.
Auf der Basis der gewonnenen Erkenntnisse sind nunmehr die meisten Vertreter der umfangreichen Fic-Proteinfamilie einer funktionellen Untersuchung zugänglich geworden. Weiterhin können Wissenschaftler mit diesem Wissen künftig detailliert den molekularen Mechanismus der Aktivierung von Fic-Proteinen unter natürlichen Bedingungen untersuchen.