Von Schnürsenkeln und Eieröffnern: Neues Photosynthese-Helferprotein in Rotalgen entdeckt
Die Photosynthese ist einer der wichtigsten biologischen Prozesse. In Pflanzen ist sie jedoch weniger effizient als sie sein könnte. Rotalgen dagegen nutzen einen geringfügig veränderten Mechanismus und sind dadurch produktiver. Forscher vom Max-Planck-Institut für Biochemie (MPIB) in Martinsried bei München haben jetzt ein bisher unbekanntes Helferprotein der Photosynthese in Rotalgen entdeckt. „Wir konnten seine Struktur und seinen faszinierenden Mechanismus entschlüsseln“, erläutert Manajit Hayer-Hartl, Gruppenleiterin am MPIB. „Der Vergleich seines Mechanismus mit dem in grünen Pflanzen könnte helfen, effizientere Pflanzen zu entwickeln.“ Ihre Arbeit wurde in Nature und Nature Structural & Molecular Biology veröffentlicht.
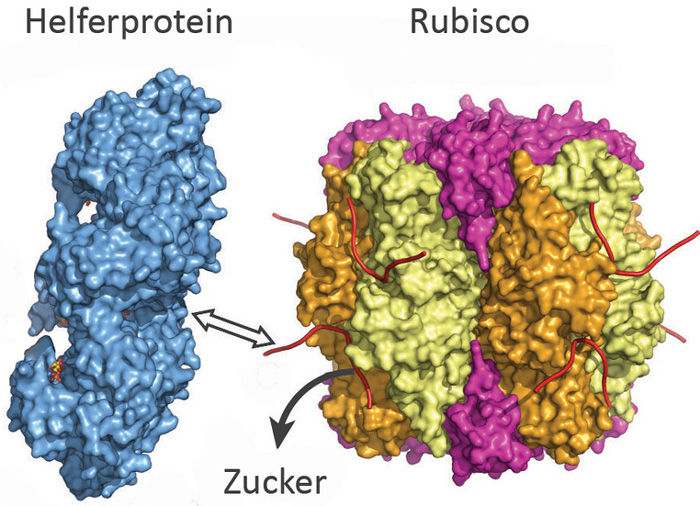
Das Helferprotein (blau) zieht an einem Ende von Rubisco (bunt) und setzt so den Zucker frei. Die Blockade ist aufgehoben.
© Manajit Hayer-Hartl / Max-Planck-Institut für Biochemie
Pflanzen, Algen und Plankton wandeln Kohlenstoffdioxid (CO2) und Wasser in Sauerstoff und Zucker um. Ohne diesen Prozess (Photosynthese) wäre das heutige Leben undenkbar. Somit ist das Schlüsselprotein der Photosynthese, das Forscher kurz Rubisco nennen, eines der wichtigsten Proteine überhaupt. Es bindet CO2 und leitet die Umwandlung in Zucker und Sauerstoff ein.
“Obwohl es so wichtig ist, steckt Rubisco voller Fehler”, sagt Manajit Hayer-Hartl, Leiterin der Forschungsgruppe “Chaperonin-vermittelte Proteinfaltung“ am MPIB. Ein Problem ist, dass Rubisco falsche Zuckermoleküle bindet, die dann seine Aktivität hemmen. Damit Rubisco seine Arbeit wieder aufnehmen kann, müssen die Zuckermoleküle von einem speziellen Helferprotein (Rubisco Aktivase) entfernt werden. Die Max-Planck-Wissenschaftler haben jetzt entdeckt, dass sich im Laufe der Evolution zwei verschiedene Rubisco Aktivasen in Pflanzen und Rotalgen entwickelt haben. Sie unterscheiden sich in ihrem dreidimensionalen Aufbau und in ihren Arbeitsmechanismen.
Zwei Wege führen zur Wiederherstellung der Rubisco-Aktivität
Die neu entdeckte Rubisco Aktivase in Rotalgen repariert blockierte Rubisco-Proteine, in dem sie an einem Ende des Proteins zieht - wie jemand, der an einem Schnürsenkel zieht. Dadurch öffnet das Helferprotein das aktive Zentrum von Rubisco und setzt so den Zucker frei. Die entsprechende Rubisco Aktivase in Grünpflanzen funktioniert dagegen eher wie ein Eieröffner: Sie quetscht das inaktive Rubisco-Protein und zwingt es so, die Zuckermoleküle frei zu lassen. „Das Verständnis der Struktur und Funktion der beiden Helferproteine könnte helfen Pflanzen und Mikroorganismen herzustellen, die effektiver arbeiten und somit mehr CO2 in Biomasse umwandeln“, hofft Manajit Hayer-Hartl.
Originalveröffentlichung
O. Mueller-Cajar, M. Stotz, P. Wendler, F. U. Hartl, A. Bracher & M. Hayer-Hartl; Structure and function of the AAA1protein CbbX, a red-type Rubisco activase; Nature, 2. November, 2011
M. Stotz, O. Mueller-Cajar, S. Ciniawsky, P. Wendler, F. U. Hartl, A. Bracher & M. Hayer-Hartl; Structure of green-type Rubisco activase from tobacco; Nature Structural & Molecular Biology, 6. November 2011
Meistgelesene News
Originalveröffentlichung
O. Mueller-Cajar, M. Stotz, P. Wendler, F. U. Hartl, A. Bracher & M. Hayer-Hartl; Structure and function of the AAA1protein CbbX, a red-type Rubisco activase; Nature, 2. November, 2011
M. Stotz, O. Mueller-Cajar, S. Ciniawsky, P. Wendler, F. U. Hartl, A. Bracher & M. Hayer-Hartl; Structure of green-type Rubisco activase from tobacco; Nature Structural & Molecular Biology, 6. November 2011
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
























































