Die innige Bindung an die Darmzelle: Forscher zeigen im Detail, wie EHEC-Bakterien sich anhaften
Jedes Jahr beschäftigen Fälle mit „Enterohämorrhagischen Escherichia coli“-Bakterien, kurz EHEC, Forscher in ganz Deutschland. Während einer Infektion besiedeln die Bakterien die Darmschleimhaut und produzieren ein Gift, das blutige Durchfälle auslöst und zu schweren Komplikationen führen kann. Forscher des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) haben nun in Zusammenarbeit mit deutschen und amerikanischen Kollegen die Anheftung von klassischen EHEC-Bakterien, Serotyp O157:H7, an die Darmzelle genauer untersucht und auf atomarer Ebene entschlüsselt, wie diese Bindung funktioniert: Nur drei winzige Bausteine eines Bakterienmoleküls, sogenannte Aminosäuren, sorgen dafür, dass die Bakterien so fest auf der Darmzelle sitzen können.
EHEC-Bakterien
Helmholtz-Zentrum für Infektionsforschung (HZI)
„EHEC sind krankheitserregende Verwandte der E. coli-Bakterien unserer gesunden Darmflora“, sagt Professor Theresia Stradal, die vor kurzem vom Braunschweiger Helmholtz-Zentrum an die Universität Münster wechselte. EHEC werden durch kontaminierte Lebensmittel und Schmierinfektionen übertragen und binden im Körper sehr fest an Darmzellen. „Dazu injizieren sie mit einer Art ‚molekularer Spritze‘ einen Proteincocktail, der in der Wirtszelle eine sogenannte Signalkaskade auslöst.“ Im Verlauf dieser Prozesse werden die Bakterien auf der Oberfläche der Darmzelle verankert und sitzen fest auf kleinen, sockelartigen Podesten. Zudem bilden die Bakterien ein Zellgift, das die schweren Durchfälle verursacht und die Gefahr von Komplikationen erhöht.
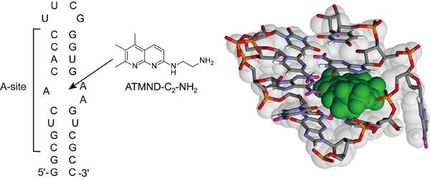
Den festen Kontakt zwischen EHEC und Darmzelle vermitteln drei Proteine, die bakteriellen Faktoren Tir und EspFU, die in die Wirtszelle injiziert werden, und IRSp53 der Darmzellen. Letzteres sammelt sich unterhalb der Oberfläche der Darmzelle und wird von dem Bakterium als Brücke zu den Wirtszellfaktoren genutzt, die die Podeste bilden und aufrechterhalten. Diese Verbindung wurde von der Arbeitsgruppe von Theresia Stradal und den amerikanischen Kollegen im Jahr 2009 erstmals erkannt und beschrieben.
Strukturbiologen des HZI haben nun diese Wechselwirkung des EHEC-Faktors Tir mit dem menschlichen Protein IRSp53 entschlüsselt. Dazu analysierten sie die atomare Struktur dieser Proteine während der Bindung aneinander. Sie entdeckten, dass zwei Tir-Proteine und ein zweikettiges IRSp53 nach dem Schlüssel-Schloss-Prinzip ineinander einrasten. Das Besondere an der Bindung: lediglich drei Bausteine des Bakterienproteins Tir sorgen für die feste Wechselwirkung und binden in einer bislang unentdeckten Furche auf der Oberfläche des Wirtsproteins IRSp53. „Die Festigkeit und Spezifität dieser Bindung war sehr überraschend“, erklärt Dr. Konrad Büssow, Leiter der Arbeitsgruppe „Strukturuntersuchungen an Faktoren der Pathogenabwehr“ am HZI.
Wenn die Forscher nur eine einzige Aminosäure entweder am bakteriellen Tir oder am menschlichen IRSp53 verändern, verschlechtert sich bereits die Bindung der Proteine aneinander. „Diese Arbeit zeigt zum ersten Mal die atomaren Details der Wechselwirkung von EHEC Tir mit dem Wirtszellen-Protein IRSp53“, so Büssow.
„Mit dem Wissen über diese neue Wechselwirkung könnte in Zukunft auch die zelluläre Rolle von IRSp53 besser verstanden werden“, sagt der Doktorand Jens de Groot, der gemeinsam mit dem Doktoranden Kai Schlüter mit einem Großteil der experimentellen Arbeit befasst war, „denn Bakterien nutzen zumeist schon existierende Bindungsstellen und funktionieren diese für ihre Zwecke um.“
Originalveröffentlichung
de Groot JC et al.; Structural Basis for Complex Formation Between Human IRSp53 and the Translocated Intimin Receptor Tir of Enterohemorrhagic E. coli. 2011 Sep 7;19(9):1294-1306.