Polymerbürsten mit Minieiweißen schützen Implantate
Infektionen an Implantaten sind gefürchtete Komplikationen bei medizinischen Eingriffen. Rund 2 bis 6 Prozent aller Patienten sind davon betroffen. Wissenschaftlern des KIT-Instituts für Funktionelle Grenzflächen (IFG) ist es gelungen, eine Schutzschicht zu entwickeln. Sie verhindert, dass Bakterien Implantate besiedeln und durch das Entstehen gefährlicher Biofilme schwerwiegende Infektionen auslösen. Im Tierversuch erwies sich die Schutzschicht als hochwirksam und zugleich als zellverträglich.
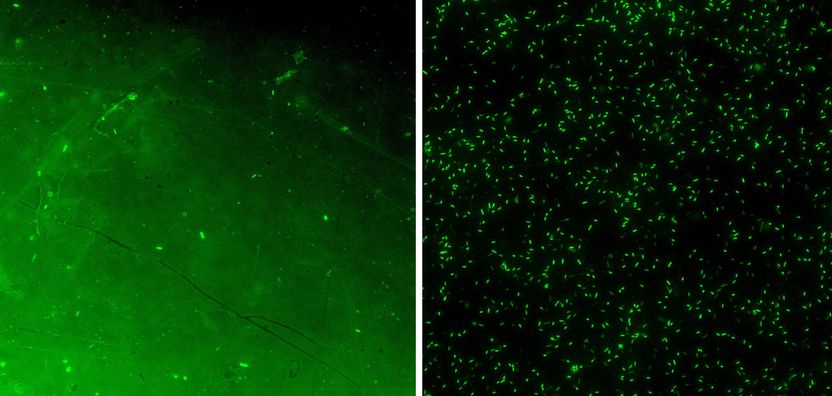
Abwehrschutz: Die Mikroskop-Aufnahmen zeigen, dass sich auf beschichteten Implantat-Stückchen (linkes Bild) deutlich weniger Bakterien ansiedeln als auf unbeschichteten.
Kai Hilpert, KIT
In Zusammenarbeit mit Kollegen der University of British Columbia haben die IFG-Wissenschaftler zunächst in einem Screening-Verfahren Verbindungen darauf getestet, ob sie eine Infektion an einer Oberfläche abwehren können. Sie untersuchten anti-mikrobielle Peptide (AMPs), kleine Eiweiße, die aus einer kurzen Kette von Aminosäuren bestehen. Diese AMPs sind hochinteressant für die Infektionsbekämpfung, weil sie sowohl gramnegative als auch grampositive Bakterien, aber auch Pilze, Viren oder Parasiten abtöten können, also eine Breitbandwirkung haben.
In einem nächsten Schritt wurden Peptide mit antibiotischer Wirkung mittels Polymeren auf Implantat-Oberflächen fixiert. Das Konstrukt, das in der Form an eine Flaschenbürste erinnert, hat mehrere Vorteile: „Durch den Träger und seine besondere Form konnten wir die Konzentration an Peptiden erhöhen. Die Fixierung verhindert zugleich eine Diffusion der anti-mikrobiellen Peptide“, so Projektleiter Dr. Kai Hilpert.
Bereits jetzt gibt es Ansätze, Implantate mit anti-mikrobiellen Stoffen zu tränken, um eine lokale Infektion zu verhindern. Dieses Verfahren erwies sich jedoch bis jetzt als wenig Erfolg versprechend wenn nicht gar als kontraproduktiv. „Durch die Diffusion der Antibiotika bildet sich ein Konzentrationsgradient, der die Resistenzbildung der Bakterien fördert“, erläutert Hilpert. Auch besteht bei dieser Methode die Gefahr der so genannten adaptiven Resistenz. „Durch den Gradienten können sich Bakterien früh auf den Wirkstoff einstellen und Abwehrstrategien aktivieren. Dadurch überleben sie eine höhere Konzentration des Antibiotikums“, so Hilpert.
Für die Infektionen sind Biofilme an den Implantaten verantwortlich. Sie entstehen, wenn sich Bakterien an dem Implantat festsetzen. „Die Bakterien entlassen bestimmte Substanzen, die ein Gerüst bilden, in dem Bakterien dreidimensional aufwachsen und sich innerhalb dieses Systems spezialisieren können“, so Hilpert. Biofilme sind um ein Vielfaches widerstandsfähiger gegenüber Antibiotika. Um Bakterien in Biofilmen abzutöten, müssen die Antibiotika-Konzen¬trationen bis um das 1000-fache erhöht werden. „Erstaunlicherweise verhindern in unserem Konstrukt die AMPs auch die Biofilmbildung“, erklärt Hilpert. Wurden beschichtete Implantat-Stücke in eine Nährlösung mit sehr hoher Konzentration von Bakterien gelegt, stellten die Wissenschaftler im Unterschied zu unbeschichteten Implantaten kaum einen Bewuchs mit Bakterien fest. Die Wirksamkeit konnte auch im Tierversuch nachgewiesen werden. Zugleich belegten Versuche in Zellkultur und an Ratten, dass die Schutzschicht biokompatibel, also unschädlich für Körperzellen ist. Bisher wurden die Beschichtungen an Titanoberflächen untersucht, da dieses Material in sehr vielen Implantaten vorkommt. „Das gleiche Prinzip lässt sich aber auch auf anderen Oberflächen anwenden, beispielsweise bei Kathetern aus Kunststoff“, so Hilpert.
„Die Ergebnisse von Dr. Hilpert und seinen Kollegen eröffnen eine neue und attraktive Option für die Beschichtung von Implantaten. Momentan werden am IFG die zugrundeliegenden Wirkungsmechanismen intensiv erforscht und die technologischen Grundlagen für eine schnelle Umsetzung entwickelt, damit baldmöglichst mit klinischen Studien begonnen werden kann“, zeichnet IFG-Direktor Prof. Dr. Christof Wöll die weiteren Perspektiven auf.