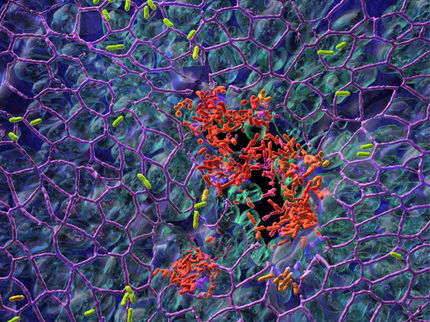
Neue Wege in der Therapie von Harnwegsinfektionen
Einen neuen Ansatz in der Behandlung von Blaseninfektionen beschreiben Forschende der Universität Basel. In der aktuellen Ausgabe des Fachmagazins «Journal of Medicinal Chemistry» stellen sie eine viel versprechende Alternative zur klassischen Therapie mit Antibiotika in Aussicht. Blaseninfektionen gehören zu den häufigsten Infektionen und bis zu einem Drittel aller Antibiotika werden zu deren Bekämpfung eingesetzt. Harnwegsinfektionen (urinary tract infections) gehören zu den häufigsten infektiösen Erkrankungen. Überwiegend handelt es sich um bakterielle Entzündungen, die in mindestens 80% der Fälle durch Escherichia coli (E.coli) aus der natürlichen, körpereigenen Darmflora ausgelöst werden.
Harnwegsinfektionen umfassen Blasenentzündungen (Zystitis), Nierenbeckenentzündungen (Pyelonephritis) und Entzündungen der Harnröhre (Urethritis). Frauen sind häufiger betroffen als Männer, da bei ihnen auch wegen der kürzeren Harnröhre Keime leichter in die Harnwege eindringen und sich dort vermehren können. Bis zu 40% der Frauen haben mindestens einmal im Leben eine Harnwegsinfektion, bei rund 50% tritt sie innerhalb eines Jahres wieder auf. Somit ist die Harnwegsinfektionen eine häufige - und im Fall eines mehrmaligen Auftretens - auch gefährliche Erkrankung. Symptomatische Harnwegsinfekte werden empirisch mit Antibiotika behandelt. Die Häufigkeit dieser Therapie führt zunehmend zu Resistenzen im behandelten Keimspektrum. Bei wiederkehrenden Infektionen wird die Therapie dadurch zunehmend erschwert. Dies betrifft insbesondere Patienten mit Diabetes, Anomalien der Harnwege, Paraplegie oder permanenten Blasenkathetern.
Folglich besteht ein grosser Bedarf nach neuen Ansätzen zur Prävention und Behandlung von Harnwegsinfektionen mittels oral verfügbaren Therapeutika mit geringem Resistenzpotenzial. Um sich im Harnweg festzuhalten und nicht mit dem Urinfluss weggespült zu werden, müssen sich die E.coli-Bakterien an ihre Zielzellen in der Blase anheften, ein Vorgang, der als bakterielle Adhäsion bezeichnet wird. Dazu verfügen die Bakterien an ihrer Oberfläche über fadenförmige Proteinstrukturen, sogenannte Fimbrien. An deren Spitze ist das Protein FimH lokalisiert, das für den Adhäsionsmechanismus verantwortlich ist. Das Protein FimH besitzt eine Kohlenhydrate-erkennende Domäne - eine sogenannte CRD (carbohydrate recognition domain) -, die Oligomannoside spezifisch erkennt. Die Wechselwirkung dieses fimbrialen Lectins mit Oligomannosiden der Wirtszellglycocalix führt zur Adhäsion der E.coli-Bakterie an die humanen Blasenepithelzellen, schützt die Bakterien vor dem Auswaschen durch den Urinfluss und ermöglicht damit die Invasion der Wirtszellen.
Nachahmung der natürlichen Liganden
Die Gruppe von Prof. Dr. Beat Ernst am Departement Pharmazeutische Wissenschaften der Universität Basel erforscht die Funktion von hoch komplexen Zuckermolekülen, sogenannten Glykanen. Wechselwirkungen zwischen Glykanen und Proteinen beeinflussen zahlreiche biologische Prozesse von der Entstehung des Embryos über die Wundheilung bis zu Autoimmunerkrankungen. Eine wichtige Rolle spielen Glykane auch bei der bakterienellen, viralen und mykotischen Infektionen. Glykanstrukturen sind aber aufgrund ihrer unzureichenden Eigenschaften im menschlichen Körper therapeutisch nur bedingt einsetzbar.
Ein Ziel der Arbeitsgruppe ist deshalb, Glykomimetika zu entwickeln, Verbindungen, die die Glykanstruktur nachahmen, die aber strukturell weniger komplex und für den therapeutischen Einsatz geeignet sind. Diesen Ansatz verfolgten Ernst und seine Mitarbeitenden auch bei der nun publizierten Studie. Ausgehend von D-Mannose gelang es ihnen, oral verfügbare Verbindungen, sogenannte FimH Antagonisten, zu entwickeln, welche die CRD an der Fimbrienspitze der E.coli blockieren und damit die bakterielle Adhäsion an die Urothelzellen der Harnwege verunmöglichen.
In einem In-vivo-Infektionsmodell mit Mäusen konnte diese Aktivität bestätigt werden, gelang es doch, die Bakterienlast in der Blase bis um einen Faktor 10’000 zu reduzieren. Von speziellem Interesse ist das geringere Resistenzpotenzial dieser neuen Verbindungsklasse, das aufgrund des molekularen Mechanismus der FimH Antagonisten zu erwarten ist.
Originalveröffentlichung
Tobias Klein et al.; "FimH Antagonists for the Oral Treatment of Urinary Tract Infections: From Design and Synthesis to in Vitro and in Vivo Evaluation"; Journal of Medicinal Chemistry, 2010