Ein Schloss, viele Schlüssel
Max-Planck-Forscher entdecken, wie die B-Zellen des Immunsystems auf unterschiedlichste Stoffe reagieren können
Anzeigen
Damit das Immunsystem Krankheitserreger aufspüren und unschädlich machen kann, muss es unzählige verschiedene körperfremde Stoffe erkennen und darauf reagieren können. Wissenschaftlern des Max-Planck-Instituts für Immunbiologie und des Centre for Biological Signalling Studies BIOSS der Universität Freiburg haben nun herausgefunden, wie die B-Zellen des Immunsystems von den zahllosen Stoffen unserer Umwelt aktiviert werden können. Demnach werden die Rezeptormoleküle auf der Oberfläche der B-Zellen erst dann aktiviert, wenn sich die Untereinheiten der Rezeptoren nach der Bindung von Fremdstoffen voneinander trennen. Die Ergebnisse stellen die bisherige Vorstellung von der Aktivierung der B-Zell-Rezeptoren auf den Kopf. Sie könnten möglicherweise dazu beitragen, neue Impfstrategien oder Behandlungsmethoden gegen B-Zell-Tumore zu entwickeln.
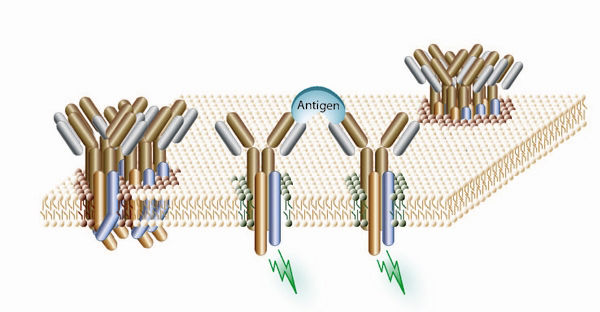
Auf ruhenden B-Zellen bildet der B-Zell-Rezeptor Oligomere aus mehreren Untereinheiten. In dieser Form sind die Rezeptoren inaktiv. Die Bindung des Rezeptors an einen passenden Bindungspartner (Antigen) führt zur Auflösung dieser oligomeren Struktur und aktiviert die Signalketten im Zellinneren (Blitze).
MPI für Immunbiologie
Viele menschliche Erkrankungen wie die steigende Zahl an Autoimmunerkrankungen oder B-Zell-Tumore wie Leukämie oder Lymphdrüsenkrebs werden durch überaktive Rezeptoren auf der Oberfläche von weißen Blutkörperchen hervorgerufen - den so genannten B-Lymphozyten, kurz B-Zellen. Jede B-Zelle trägt bis zu 120.000 B-Zell-Rezeptoren auf ihrer Oberfläche und die Aktivierung dieser Rezeptoren regt die Zelle zur Bildung von Antikörpern an. Die Rezeptoren funktionieren dabei nach dem Schlüssel-Schloss-Prinzip, bei dem nur ein passender Stoff (Schlüssel) den Rezeptor (Schloss) aktivieren und eine Immunantwort auslösen kann. Wenn Millionen von Schlüsseln ein Schloss aufschließen können, stellt sich die Frage, wie dieses Schloss funktioniert und wie wir vor einer anhaltenden Überaktivität unserer Immunabwehr geschützt werden.
Jianying Yang und Michael Reth haben jetzt eine Antwort gefunden, die das Problem der Aktivierung des Immunsystems erklärt. Mit Hilfe von Methoden der Synthetischen Biologie bauten sie den B-Zell-Rezeptor von Mäusen in einer Fruchtfliegenzelle nach. Anders als die bisherige Forschung interessierte sie der Rezeptor auf ruhenden B-Zellen, also den noch nicht aktivierten Zellen. Das überraschende Ergebnis: Der Rezeptor auf ruhenden B-Zellen besteht aus mehreren verschiedenen Untereinheiten und bildet so genannte Oligomere. In dieser Form sind für die Signalweiterleitung wichtige Abschnitte der Rezeptoren verdeckt. Bindet ein passender Bindungspartner an den Rezeptor, zerfallen die Oligomere, und die einzelnen Untereinheiten können aktiv werden. "Der Trennungsprozess ist weitgehend unabhängig von der Struktur des Bindungspartners. So lässt sich erklären, warum der B-Zell-Rezeptor von tausenden unterschiedlichen Stoffen aktiviert werden kann", erklärt Michael Reth vom Max-Planck-Institut für Immunbiologie. Die Entdeckung, dass die Untereinheiten der B-Zell-Rezeptoren geordnete Oligomer-Komplexe bilden, lässt zudem darauf schließen, dass die Rezeptoren auf ruhenden B-Zellen nur unter genau definierten Bedingungen aktiviert werden.
Das neue Modell der Aktivierung des Rezeptors widerspricht der bislang anerkannten Lehrmeinung. Bislang war man der Ansicht, dass die Rezeptoren ungeordnet in der Zellmembran vorliegen und sich erst nach Kontakt mit einem Bindungspartner zusammenlagern. "Unser neues Modell beruht dagegen auf der Auflösung und nicht auf der Bildung einer bestimmten Rezeptorstruktur. Dies ist eine Wende in der immunologischen Forschung und möglicherweise in der gesamten Zellbiologie", betont Michael Reth. Denn auch andere Rezeptormoleküle bilden offenbar im Ruhezustand Oligomere, die erst aktiv werden, wenn sie in ihre Untereinheiten zerfallen oder ihre Konformation ändern.
Originalveröffentlichung: Jianying Yang and Michael Reth; "Oligomeric organization of the B cell antigen receptor on resting cells"; Nature, 467:465-469: 23. September 2010