Immunsystem trifft auf Krebs: Kontrollpunkt zur Bekämpfung von soliden Tumoren identifiziert
Checkpoint PHDGH in Tumor-assoziierten Makrophagen beeinflusst Immunantwort und Tumorwachstum
Anzeigen
Eine aktuell in der hochkarätigen Fachzeitschrift Cellular & Molecular Immunology erschienene Studie eines Wissenschaftsteams der Universität Wien und der MedUni Wien lässt mit einem vielversprechenden Ergebnis aus der Tumorforschung aufhorchen: Das Enzym Phosphoglyceratdehydrogenase (PHDGH) wirkt als metabolischer Checkpoint bei der Funktion von Tumor-assoziierten Makrophagen (TAMs) und damit auf das Tumorwachstum. Die gezielte Beeinflussung der PHGDH zur Modulation des den Krebs bekämpfenden Immunsystems könnte also ein neuer Ansatzpunkt in der Krebsbehandlung sein und die Wirksamkeit klinischer Immuntherapien verbessern.
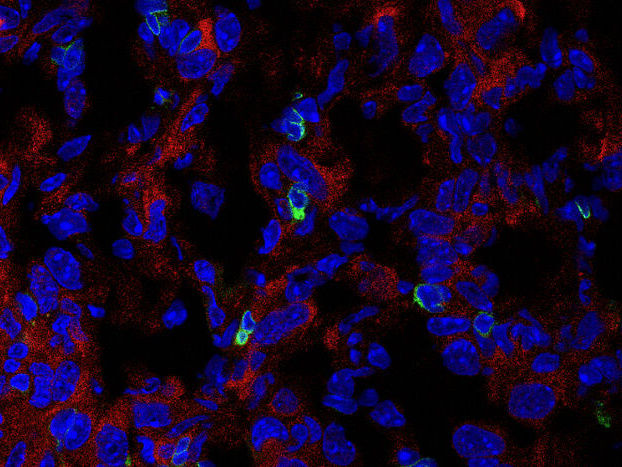
Immunfluoreszenzbild der Expression von PHGDH (rot) und CD3-T-Zellen (grün) im kryogeschnittenen AE17-Mesotheliom.
C: Zhengnan Cai
Permanent bekämpft unser Immunsystem aufstrebende Krebszellen, die durch Mutationen entstehen. Dieser Prozess wird unter anderem durch unterschiedliche Makrophagen-Typen gesteuert. Tumor-assoziierte Makrophagen (TAMs) gehören zu den am häufigsten vorkommenden Immunzellen in der Mikroumgebung eines Tumors. Sie stammen von im Blut zirkulierenden und gewebeansässigen Immunzellen ab, die in den Tumor eindringen und sich dort in Reaktion auf verschiedene Botenstoffe (Zytokine) und Wachstumsfaktoren differenzieren. Bei den meisten soliden (festen) Tumoren gelten paradoxerweise TAMs insgesamt als tumorfördernd ("protumorigen"): Sie begünstigen das Tumorwachstum und die Metastasierung, indem sie die Immunantwort unterdrücken, die Gefäßversorgung des Tumors fördern und auch die Resistenz gegen medikamentöse Therapien erhöhen – d.h. sie korrelieren allgemein mit einer schlechten Prognose für die betroffenen Patient*innen. Frühere Versuche, TAMs zu beeinflussen, erwiesen sich als unbefriedigend, weil viele Patient*innen nur begrenzt auf diese Therapieansätze ansprachen. Dies unterstreicht die Dringlichkeit der Suche nach neuen Wirkstoffen und Strategien.
Künstliche Intelligenz und maschinelles Lernen erlaubt die genaue Diagnostik von metabolischen Markern und Identifizierung von Kontrollpunkten
Systembiologe und Biochemiker Wolfram Weckwerth vom Department für Funktionelle und Evolutionäre Ökologie der Universität Wien und Letztautor der Studie erklärt: "Bereits in unserer früheren Arbeit haben wir innovative Methoden des maschinellen Lernens und der künstlichen Intelligenz in Kombination mit molekularen Analysen entwickelt und damit einen neuen metabolischen Checkpoint in Makrophagen entdeckt. Unsere sogenannte ‚COVRECON-Strategie‘ ist ein Ansatz, der verschiedene Techniken aus der Biochemie, Genetik und Metabolomik mit Prinzipien der mathematischen Kontrolltheorie und Analyse dynamischer Systeme kombiniert, um Informationen über Stoffwechselprozesse in Zellen zu erhalten. Damit wenden wir grundlegende Konzepte der künstlichen Intelligenz, die typischerweise in der Regelungstechnik Einsatz finden, in der Biologie, Ökologie und Medizin an, um Prozesse besser zu verstehen." Dabei fanden die Forscher*innen heraus, dass die Aktivität des Enzyms PHDGH über verschiedene Signalwege gesteuert wird und seinerseits wiederum die zelluläre Aktivität der Makrophagen beeinflusst. Da TAMs einem Subtyp der normalen Makrophagen – nämlich M2 – in ihren Eigenschaften als immunsuppressive und damit protumorigene Immunzellen ähneln, machte sich das Wissenschaftsteam daran, den Einfluss von PHDGH auf ihre Funktionalität und das Tumorwachstum zu untersuchen.
Durch Knock-Out in die nächste Runde
"In der aktuellen Studie haben wir gemeinsam mit Kolleg*innen der MedUni Wien genetische Ansätze verwendet, um die Funktion der PHDGH in Makrophagen zu untersuchen", erklärt Studien-Erstautor Zhengnan Cai von der Universität Wien. "Dabei haben wir entdeckt, dass PHGDH für die Aktivierung des immunsuppressiven protumorigenen M2-Subtyps nötig ist. Die Unterdrückung des PHGDH-Gens hingegen begünstigte die Entwicklung zu Makrophagen vom antitumorigenen Typ (M1) und verringerte das Tumorwachstum." Das Forschungsteam konnte nachweisen, dass der von PHGDH-vermittelte Serin-Stoffwechselweg eine entscheidende Rolle in Prozessen spielt, die mit der Regulation des mTORC1-Signalwegs (Schlüsselrolle in der Regulation von Zellwachstum, Zelldifferenzierung und Zellstoffwechsel), der Aktivierung von immunsuppressiven M2-Makrophagen und Expansion von TAMs sowie der Regulation des bekannten Immuncheckpoints PD-L1 verbunden sind. Wolfram Weckwerth fasst zusammen: "Unsere Studie liefert grundlegende Erkenntnisse für das Verständnis der Wechselwirkung von Immunregulation und Krebsentwicklung und zeigt das Potenzial auf, eine Strategie zur Modulation der TAMs in der Bekämpfung von Tumoren zu entwickeln. Allerdings benötigen wir dafür noch weitere Forschung."
Originalveröffentlichung
Targeting PHGDH reverses the immunosuppressive phenotype of tumor-associated macrophages through α-ketoglutarate and mTORC1 signaling. Zhengnan Cai, Wan Li, Sonja Hager, Jayne Louise Wilson, Leila Afjehi-Sadat, Elke H. Heiss, Thomas Weichhart, Petra Heffeter and Wolfram Weckwerth; Cellular & Molecular Immunology