SARS-CoV-2-Protein unterbricht kritischen Immunitätspfad
Röntgenstrahlen zeigen, dass die primäre Verdrahtung unseres Immunsystems einem brutalen SARS-CoV-2-Protein nicht gewachsen zu sein scheint
In den vergangenen zwei Jahren haben Wissenschaftler das SARS-CoV-2-Virus eingehend untersucht und damit die Grundlage für die Entwicklung von COVID-19-Impfstoffen und antiviralen Behandlungen gelegt. Jetzt haben Wissenschaftler des SLAC National Accelerator Laboratory des Energieministeriums zum ersten Mal eine der kritischsten Interaktionen des Virus beobachtet, was den Forschern helfen könnte, präzisere Behandlungen zu entwickeln.
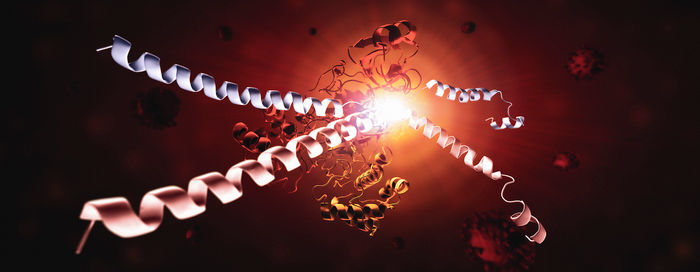
Dieses Bild zeigt die Hauptprotease des SARS-CoV-2-Virus, Mpro, und zwei Stränge eines menschlichen Proteins, genannt NEMO. Ein NEMO-Strang (blau) wurde von Mpro zerschnitten, und der andere NEMO-Strang (rot) wird gerade von Mpro zerschnitten. Ohne NEMO ist das Immunsystem langsamer in der Lage, auf steigende Viruslasten oder neue Infektionen zu reagieren. Zu sehen, wie Mpro NEMO auf molekularer Ebene angreift, könnte zu neuen therapeutischen Ansätzen inspirieren.
Greg Stewart/SLAC National Accelerator Laboratory
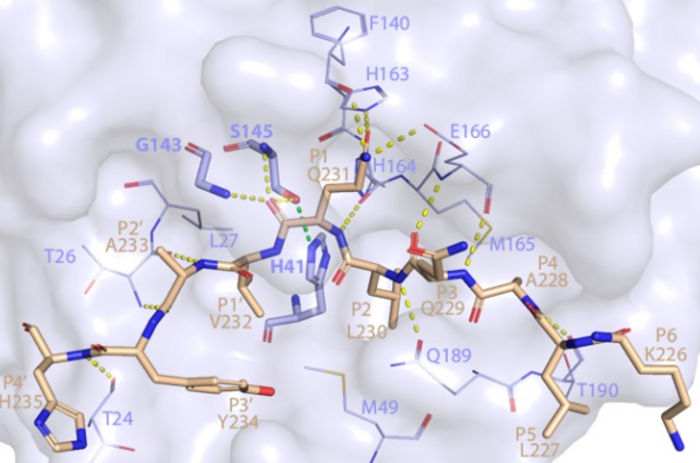
Dieses Bild zeigt, wie SARS-CoV-2 Mpro NEMO erkennt und schneidet, basierend auf der Kristallstruktur, die mit einem starken Röntgenstrahl an der SSRL Beam Line 12-2 bestimmt wurde.
SLAC National Accelerator Laboratory
Das Team hat den Moment erfasst, in dem ein Virusprotein namens Mpro ein Schutzprotein namens NEMO in einer infizierten Person schneidet. Ohne NEMO ist das Immunsystem langsamer in der Lage, auf steigende Viruslasten oder neue Infektionen zu reagieren. Zu sehen, wie Mpro NEMO auf molekularer Ebene angreift, könnte neue therapeutische Ansätze inspirieren.
Um zu sehen, wie Mpro NEMO schneidet, leiteten die Forscher starke Röntgenstrahlen von der Stanford Synchrotron Radiation Lightsource (SSRL) des SLAC auf kristallisierte Proben des Proteinkomplexes. Die Röntgenstrahlen trafen auf die Proteinproben und enthüllten, wie Mpro aussieht, wenn es die Hauptfunktion von NEMO, die Kommunikation unseres Immunsystems zu unterstützen, zerlegt.
"Wir haben gesehen, dass das Virusprotein NEMO so leicht durchschneidet wie eine scharfe Schere durch dünnes Papier", sagt Co-Autor Soichi Wakatsuki, Professor am SLAC und in Stanford. "Stellen Sie sich vor, was für schlimme Dinge passieren, wenn gute Proteine in unserem Körper in Stücke geschnitten werden".
Die Bilder von SSRL zeigen die genaue Stelle des NEMO-Schnitts und liefern die erste Struktur von SARS-CoV-2 Mpro, das an ein menschliches Protein gebunden ist.
"Wenn man die Stellen blockieren kann, an denen Mpro an NEMO bindet, kann man verhindern, dass dieser Schnitt immer wieder stattfindet", sagte der leitende SSRL-Wissenschaftler und Co-Autor Irimpan Mathews. "Wenn man Mpro stoppt, könnte man die Geschwindigkeit verlangsamen, mit der das Virus einen Körper erobert. Die Lösung der Kristallstruktur enthüllte die Bindungsstellen von Mpro und war einer der ersten Schritte, um das Protein zu stoppen."
Das Forscherteam vom SLAC, dem Oak Ridge National Laboratory des DOE und anderen Institutionen veröffentlichte seine Ergebnisse in Nature Communications.
Schutz eines Immunitätsweges
NEMO ist Teil des menschlichen Immunsystems, das als NF-κB-Signalweg bekannt ist. Man kann sich NEMO und den NF-κB-Weg wie ein Kartenlesegerät und eine Verkabelung an der Außenseite einer verschlossenen Eingangstür eines Gebäudes vorstellen. Wenn die Drähte zum Kartenleser durchtrennt werden, lässt sich die Tür nicht öffnen, was bedeutet, dass eine Person (oder ein Aktivator des Immunsystems wie NEMO) draußen festsitzt und nicht in der Lage ist, das zu tun, was sie tun wollte.
Der NF-κB-Signalweg ist ein wichtiger Bestandteil der schützenden Entzündungsreaktionen. Wenn NEMO ausgeschaltet ist, kann unsere Immunreaktion nicht aktiviert werden, was zu verschiedenen schädlichen Auswirkungen auf unseren Körper führt. COVID-19-Virusinfektionen könnten sich verschlimmern, wenn Mpro NEMO zerstört und damit dem Virus hilft, unsere angeborenen Immunreaktionen zu umgehen. Darüber hinaus hat eine separate Studie von Forschern an Einrichtungen in Deutschland ergeben, dass der Verlust von NEMO durch die Wirkung von Mpro zu einer Schädigung bestimmter Gehirnzellen führen könnte, was die bei COVID-19-Patienten beobachteten neurologischen Symptome verursacht, so die Forscher.
Ein Medikament, das derzeit für den Notfalleinsatz zugelassen ist, zielt auf Mpro-Proteine ab, indem es einer infizierten Person einen Mpro-Hemmer verabreicht. Diese Art von Hemmstoff könnte jetzt, da der Ort des NEMO-Schnitts entdeckt wurde, verstärkt werden.
"Die Kristallstrukturen von NEMO und Mpro liefern uns die Ziele für die Entwicklung von Behandlungen, die diese Schnitte verhindern", sagte der SLAC-Wissenschaftler und Co-Erstautor Mikhail Ali Hameedi. "Obwohl aktuelle antivirale Medikamente auf Mpro abzielen können, wird uns die Kenntnis der molekularen Details, wie Mpro NEMO angreift, dabei helfen, in Zukunft neue Behandlungen zu entwickeln, wenn Mpro mutiert."
Die Suche nach Möglichkeiten zur Verbesserung antiviraler Hemmstoffe ist bei SARS-CoV-2 besonders wichtig. Unter den Coronaviren - einer Gruppe, zu der auch die ursprünglichen SARS-CoV- und MERS-CoV-Viren gehören - ist das Mpro von SARS-CoV-2 das wirksamste Virus, das sich an NEMO anheftet und es zerschneidet. Das Mpro von SARS-CoV-2 hält NEMO fester als seine Gegenstücke in anderen Coronaviren und könnte Hunderte von anderen kritischen Proteinen in menschlichen Wirtszellen schneiden, z. B. solche, die mit Blutkrankheiten in Verbindung stehen, so die Forscher.
Um vorherzusagen, wie gut Mpro an NEMO bindet, nutzten die Forscher den Supercomputer Summit der Oak Ridge Leadership Computing Facility. Sie kombinierten Molekulardynamiksimulationen mit fünf Modellen des maschinellen Lernens auf neuartige Weise und wendeten Quantenchemie an. Dabei stellten sie fest, dass Mpro bei SARS-CoV-2 im Vergleich zu den anderen primären Coronaviren wahrscheinlich die höchste Bindungsaffinität aufweist. In früheren Studien haben diese Techniken den Wissenschaftlern geholfen, eine Liste potenzieller antiviraler Hemmstoffe einzugrenzen.
"Mit einer Reihe von Berechnungsansätzen konnten wir die stärksten Bindungsstellen zwischen NEMO und Mpro vorhersagen", sagte die Ko-Erstautorin und ORNL-Wissenschaftlerin Erica Prates. "Wir glauben, dass eine hohe Bindungsaffinität an diesen Hotspots die hohe Fitness des Virus beim Menschen erklärt."
In Zukunft könnte die biomedizinische Industrie die Studie nutzen, um bessere Hemmstoffe zu entwickeln und zu verstehen, wie andere Proteine von Mpro beeinflusst werden könnten, so Wakatsuki.
"NEMO ist nur die Spitze des Eisbergs", sagte er. "Wir können jetzt untersuchen, was passiert, wenn viele andere Proteine im Körper während einer Infektion von Mpro gespalten werden."
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.


























































