Palmitoylierung, ein neues Ziel für Krebsmedikamente
Durch die Entwicklung eines Instruments zur Visualisierung der Membranassoziation und des Aktivierungsstatus normaler und onkogener Proteine haben Wissenschaftler die Grundlage für die Entdeckung innovativer Medikamente geschaffen
Anzeigen
Periphere Membranproteine haben die Besonderheit, sich vorübergehend an Zellmembranen zu binden, ein notwendiger Schritt, damit sie ihre biologische Funktion erfüllen können. Dazu kommen bestimmte Enzyme zum Einsatz, die ihre Lipidmodifikation katalysieren. Dieser Vorgang wird als "Palmitoylierung" bezeichnet. Einige dieser Proteine können mutieren und onkogen werden, wie z. B. die RAS-Proteine, die für etwa ein Drittel der Krebserkrankungen verantwortlich sind. Um die Funktionsweise der Palmitoylierung zu verstehen und sie für therapeutische Zwecke zu nutzen, haben Wissenschaftler der Universität Genf (UNIGE), Schweiz, ein neuartiges Instrument entwickelt, um diesen Prozess in lebenden Zellen sichtbar zu machen. Sie haben gezeigt, dass die Palmitoylierung, anders als bisher angenommen, nicht nur im Golgi-Apparat, dem üblichen Ort für die Verarbeitung und den Transport von Proteinen, möglich ist, sondern auch an dem Ort, an dem das Protein wirken muss, z. B. an der Plasmamembran. Diese Entdeckung, die in der Fachzeitschrift Nature Communications zu lesen ist, ebnet den Weg für innovative Strategien zur Entdeckung von Medikamenten, die sehr genau auf die Membranbindung - und damit auf die Aktivität - von onkogenen Proteinen abzielen.
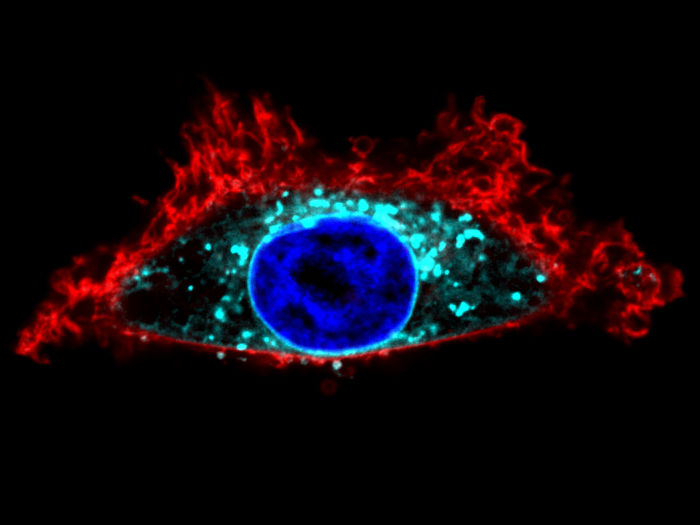
Visualisierung mit dem SwissKASH-Tool einer Zelle der Zelllinie HeLa. Das Gαo-Protein (in Türkis) wird an der Kernmembran (in Blau) rekrutiert.
Gonzalo Solis / UNIGE
Bei der Palmitoylierung werden Fettsäuren in bestimmte Proteine eingebaut, damit diese an Zellmembranen binden können. Dieser Mechanismus unterliegt präzisen Regeln, die von der Sequenz jedes Proteintyps und dem Vorhandensein spezialisierter Enzyme abhängen. Bisher ging die Wissenschaft davon aus, dass die Palmitoylierung der peripheren Membranproteine nur an einem Ort in der Zelle stattfinden kann, nämlich im Golgi-Apparat.
"Tatsächlich werden diese Proteine im Zytosol - der Zellflüssigkeit - produziert und 'schwimmen' dann zum Golgi-Apparat, wo sie modifiziert werden, bevor sie dorthin transportiert werden, wo sie wirken sollen", erklärt Gonzalo Solis, Forscher in der Abteilung für Zellphysiologie und Metabolismus an der medizinischen Fakultät der UNIGE und Hauptautor dieser Arbeit. "Wir haben jedoch die Hypothese aufgestellt, dass eine lokale Palmitoylierung möglich ist, ohne den Golgi-Apparat zu durchlaufen. Wenn dies zutrifft, eröffnen sich völlig neue Möglichkeiten, in diesen Mechanismus einzugreifen."
Beobachtung und Manipulation von Proteinen
Um diese Hypothese zu testen, konzentrierte sich das Forschungsteam unter der Leitung von Vladimir Katanaev, Professor in der Abteilung für Zellphysiologie und Stoffwechsel und am Zentrum für translationale Forschung in der Onko-Hämatologie an der medizinischen Fakultät der UNIGE, auf ein Protein namens Gαo, das sich normalerweise an der Plasmamembran und im Golgi-Apparat befindet.
Die angewandte Methodik ist völlig neu: "Wir haben die palmitoylierenden Enzyme in ein völlig anderes Kompartiment der Zelle gebracht, nämlich in die Kernmembran", erklärt Gonzalo Solis. "Gαo wurde an der Kernmembran rekrutiert, was es uns ermöglichte, das spezifische Enzym zu identifizieren, das sie palmitoyliert. Damit haben wir bestätigt, dass dieser Prozess genau an dem Ort stattfinden kann, an dem das Protein benötigt wird."
Im Gegensatz zu den üblichen biochemischen Methoden ist das von Vladimir Katanaev und seinem Team entwickelte Werkzeug, das sie SwissKASH nannten, auch das erste, das die Zelle am Leben erhält und eine dynamische Beobachtung des Prozesses ermöglicht. "Bisher gab es keine Alternative zur Zerstörung der Zelle", sagt Vladimir Katanaev. "Mit unserer Methode lässt sich auch genau bestimmen, welches Protein lokal auf welches Enzym reagiert, was unerlässlich ist, wenn wir diesen Mechanismus zu therapeutischen Zwecken kontrollieren wollen."
Ein neues Ziel für Medikamente
Mehrere periphere Membranproteine, insbesondere Gα-Untereinheiten und RAS-Proteine, sind anfällig für Mutationen und erwerben dadurch ein aggressives onkogenes Potenzial. Ihre Onkogenität hängt von ihrer Fähigkeit ab, an die Plasmamembran zu binden; die Palmitoylierung spielt somit eine Schlüsselrolle bei der Umwandlung einer gesunden Zelle in eine Krebszelle.
"Die Hemmung des Enzyms, das die Palmitoylierung auslöst, und die Verhinderung der Bindung des onkogenen Proteins an die Plasmamembran könnte daher seine Pathogenität entschärfen", betont Gonzalo Solis. "Wir können uns also vorstellen, diese spezifische Reaktion zu blockieren, ohne das gesamte System aus dem Gleichgewicht zu bringen". Die Wissenschaftler werden nun versuchen, diese Methode zu automatisieren, um die Wirkung einer ganzen Reihe von Arzneimitteln auf die Palmitoylierung ausgewählter Onkoproteine zu untersuchen und ihre Toxizität auf die gesamte Zelle zu testen.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.























































