Wie Zellen des Immunsystems das Label erkennen, das Krankheitserreger zur Zerstörung markiert
Studie beschreibt auf atomarer Ebene, wie zwei Schlüsselproteine im Kampf gegen Infektionen zusammenwirken und erkannt werden
Wissenschaftler des Biologischen Forschungszentrums Margarita Salas des CSIC (CIB-CSIC) haben gemeinsam auf atomarer Ebene erklärt, wie einer der wichtigsten Mechanismen funktioniert, mit denen das Immunsystem Krankheitserreger erkennt. Die in Nature Communications veröffentlichte Studie zeigt, wie CR3-Rezeptoren auf der Oberfläche von Makrophagen und anderen Immunzellen das iC3b-Molekül erkennen, mit dem das Komplementsystem Krankheitserreger markiert, damit sie durch Phagozytose zerstört werden können. Diese Erkenntnis könnte zur Entwicklung von Strategien gegen Autoimmun- und Entzündungskrankheiten beitragen.
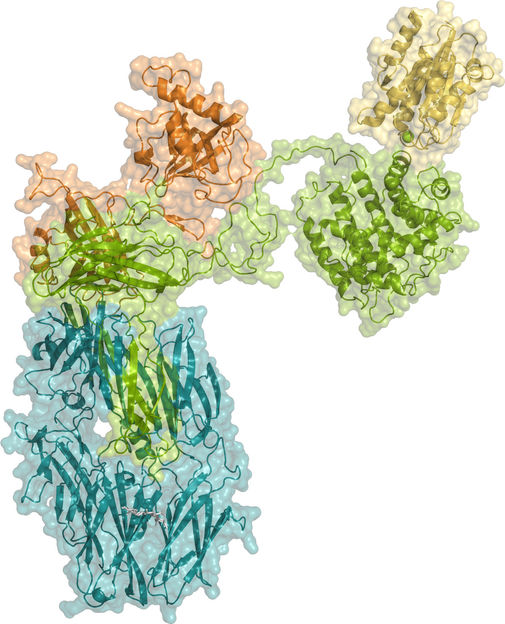
Kristallographische Struktur von iC3b im Komplex mit der αI-Domäne von CR3.
CIB-CSIC
Das Komplementsystem ist eine grundlegende Komponente der angeborenen Immunität des Menschen. Es besteht aus mehr als 30 Proteinen im Plasma sowie aus Rezeptoren und Regulatoren an der Membran vieler Zellen und wird durch die Anwesenheit von Krankheitserregern und anderen Substanzen, die es als fremd erkennt, aktiviert. "Es ist unsere erste Verteidigung gegen Infektionen durch Krankheitserreger und hat die Aufgabe, Krankheitserreger mit molekularen Signalen zu markieren, um sie zu zerstören", sagt CIB-CSIC-Forscherin M. Cristina Vega, Hauptautorin der Studie.
Wenn das Komplement an der Oberfläche von Krankheitserregern aktiviert wird, durchläuft das C3-Protein, eines der häufigsten Proteine im Plasma, eine Reihe von Umwandlungen, die zur kovalenten Bindung von Tausenden aktivierter C3-Moleküle an die Oberfläche des Erregers führen (Opsonisierung). Das wichtigste Bindungsprotein oder Opsonin ist iC3b, eines der aktivierten C3-Moleküle.
Die Opsonierung ist für die Infektionsbekämpfung von entscheidender Bedeutung, da die Effektorzellen des Immunsystems in der Lage sind, iC3b-opsonierte Krankheitserreger als Bedrohung zu erkennen, sich an sie zu heften und sie zu phagozytieren. Zu diesem Zweck verwenden Makrophagen ein komplexes Protein auf ihrer Oberfläche, den Komplementrezeptor 3 (CR3). Die Interaktion zwischen iC3b und CR3 ist daher für die Adhäsion und Phagozytose von iC3b-beschichteten Krankheitserregern durch Makrophagen verantwortlich. Die von den CIB-CSIC-Forschern vorgestellte Arbeit enthüllt die molekularen Details, wie diese Interaktion zwischen iC3b und CR3 zustande kommt.
"Mit dieser Arbeit haben wir entdeckt, dass die Interaktion von iC3b und CR3-Proteinen modular aufgebaut ist. Diese Modularität verleiht der Interaktion eine große Vielseitigkeit und Spezifität und begünstigt die Erkennung von Krankheitserregern in Gebieten mit einer hohen Dichte an iC3b-Molekülen. Eine Fehlfunktion dieser Proteine kann zu einer erhöhten Anfälligkeit für Infektionen und seltene Autoimmunkrankheiten führen", erklärt Vega.
Obwohl die allgemeine Funktion von iC3b bekannt war, waren seine atomare Struktur sowie die Einzelheiten der Spezifität von iC3b und der Erkennung durch CR3 unbekannt. Diese neue Studie vervollständigt die Informationen über diese beiden wichtigen Proteine zur Infektionsbekämpfung. "Die Auflösung der Struktur dieses Komplexes ist ein wichtiger Schritt, um zu verstehen, wie Zellen des Immunsystems die Aktivität des Komplementsystems nutzen, um Krankheitserreger aufzuspüren und zu zerstören - ein Prozess, der für die Erhaltung der Gesundheit gegen viele Infektionserreger unerlässlich ist", sagt Francisco J. Fernández, Erstautor der Studie.
"Dies erklärt frühere Daten, die wir nicht vollständig verstanden haben, und eröffnet die Möglichkeit, in das Komplementsystem einzugreifen, um diesen Prozess zu begünstigen", erklärt Santiago Rodríguez de Córdoba, Forschungsprofessor am CIB-CSIC und Mitarbeiter an dieser Arbeit.
Die Arbeitsgruppen von Vega und Rodríguez de Córdoba gehören zur Global Health Platform des CSIC, wo sie an Studien zur Behandlung der schwersten Symptome von Covid-19 mit Strategien arbeiten, die auf das Komplementsystem ausgerichtet sind. Die beiden Gruppen haben zuvor neue Mechanismen der Immunabwehr bei Streptococcus pyogenes und anderen pathogenen Bakterien beschrieben, die die Rolle des Komplementproteins C5a beeinträchtigen und die Anziehungskraft von Neutrophilen auf Infektionsherde verringern. Ihre veröffentlichten Arbeiten werden die Entwicklung von Strategien zur Modulation der CR3-Aktivität bei Autoimmun- und Entzündungskrankheiten erleichtern.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Spanisch finden Sie hier.
Originalveröffentlichung
Fernández FJ, Santos-López J, Martínez-Barricarte R, Querol-García J, Martín-Merinero H, Navas-Yuste S, Savko M, Shepard WE, Rodríguez de Córdoba S y Vega MC.; "The crystal structure of iC3b-CR3 αI reveals a modular recognition of the main opsonin iC3b by the CR3 integrin receptor."; Nature Communications.