Zum ersten Mal werden DNA und Proteine durch neu entwickelte Nanoporen erfasst
Diese Errungenschaft könnte dazu beitragen, die Beziehung zwischen Proteinstruktur und -funktion besser zu verstehen
Anzeigen
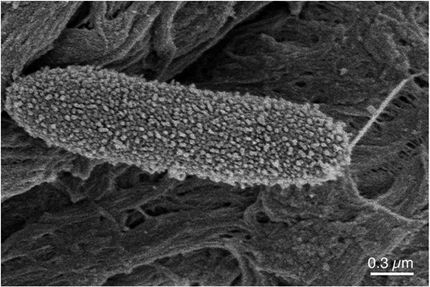
Forscher in Japan haben die ersten von unten nach oben entworfenen Peptide, bestehend aus Aminosäureketten, entwickelt, die künstliche Nanoporen bilden können, um genetisches Material in einer Lipidmembran zu identifizieren und die Sortierung einzelner Moleküle zu ermöglichen.

De novo Design einer Nanopore für den Einzelmolekülnachweis, die ein β-Hairpin-Peptid enthält
Ryuji Kawano, Tokyo University of Agriculture and Technology
Biologische Nanoporen sind in der Regel Kanäle, die von porenbildenden Proteinen gebildet werden und bestimmte Moleküle aufspüren können. Solche natürlichen Kanäle sind jedoch schwer zu identifizieren, was die vorgeschlagenen Anwendungen für die kostengünstige und schnelle DNA-Sequenzierung, den Nachweis kleiner Moleküle und vieles mehr einschränkt.
"Nanopore Sensing ist ein leistungsfähiges Werkzeug für den markierungsfreien Einzelmolekülnachweis", sagte der korrespondierende Autor Ryuji Kawano, Professor an der Tokyo University of Agriculture and Technology (TUAT) in Japan. "Dies ist das erste Mal, dass DNA und Polypeptide mit einer de novo entworfenen Nanopore erfasst wurden."
Die de novo entworfenen Nanoporen werden laut Kawano "von Grund auf" gebaut und haben das Potenzial, natürliche Proteine und ihre Fähigkeit, spezifische Proteine zu erkennen, zu imitieren. Entscheidend ist, so Kawano, dass sie auch so konstruiert werden können, dass sie als künstliche molekulare Maschinen fungieren, die in der Lage sind, eine viel breitere Palette von Molekülen aufzuspüren - was dazu beitragen könnte, den Zusammenhang zwischen Struktur und Funktion von Zielproteinen zu erhellen.
"Die gefaltete Struktur von Proteinen wird durch ihre lineare Polypeptidsequenz bestimmt und führt zu einer spezifischen Proteinfunktionalität", sagte Kawano und merkte an, dass alle Proteine eine einzigartige Struktur und Größe haben. "Die einzigartige Primärstruktur ist das Ergebnis der strukturellen Evolution, etwa der Mutation und Selektion von Aminosäureresten im Laufe der Zeit. Die Beziehung zwischen dieser Primärinformation und der Proteinstruktur aufzudecken, ist eines der ultimativen Ziele der Wissenschaft".
Um große synthetische Nanoporen zu entwickeln, mit denen Moleküle für praktische Anwendungen besser aufgespürt und identifiziert werden können, entwarfen Kawano und das Team ein Peptid mit der Bezeichnung SV28. Mit zwei Aminosäurearmen, die in einem spitzen Winkel gebogen sind, und spezifischen Ladungen am Ende kann die Ausrichtung des haarnadelförmigen Peptids durch Anlegen einer Spannung präzise gesteuert werden. Das Peptid kann sich zu Nanoporenstrukturen mit einer Größe von 1,7 bis 6,3 Nanometern zusammenfügen, die für den Nachweis von DNA-Molekülen geeignet sind.
Die Forscher veränderten SV28 auch, indem sie eine Mutation hinzufügten, die bewirkt, dass sich die Peptidstruktur auf bestimmte Weise biegt und verdreht. Das resultierende Peptid bildete gleichmäßig verteilte Poren von jeweils 1,7 Nanometern, die eine einzelne Polypeptidkette - oder eine Hälfte eines Proteins - erkennen können.
Diese Errungenschaft könnte dazu beitragen, die Beziehung zwischen Proteinstruktur und -funktion besser zu verstehen.
Für die nächsten Schritte plant das Team, verschiedene Peptide und Proteine zu entwerfen, um verschiedene Arten von Nanoporen zu konstruieren, die bei der Peptidsequenzierung helfen, als molekulare Roboter funktionieren und vieles mehr.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.