Molekül attackiert Coronavirus auf neuartige Weise
Wissenschaftler der Universität Bonn und des Forschungszentrums caesar haben ein Molekül isoliert, das neue Wege im Kampf gegen das SARS-Coronavirus 2 eröffnen könnte. Der Wirkstoff bindet an das Spike-Protein, mit dem die Erreger an die Zellen andocken, die sie infizieren. Er verhindert damit zumindest bei Modellviren, dass sie in die jeweilige Zelle gelangen. Dazu nutzt er augenscheinlich einen anderen Mechanismus als bislang bekannte Hemmstoffe. Die Forscher vermuten daher, dass er auch gegen Virusmutanten helfen könnte.

Das Team (von links): Prof. Dr. Günter Mayer, Prof. Dr. Michael Famulok, Dr. Anna Maria Weber und Dr. Anton Schmitz vom LIMES-Institut der Universität Bonn. Prof. Famulok arbeitet außerdem am Forschungszentrum caesar in Bonn.
© Volker Lannert/Uni Bonn
Bei dem neuartigen Wirkstoff handelt es sich um ein sogenanntes Aptamer. Das sind kurze Ketten aus DNA, der chemischen Verbindung also, aus der auch die Chromosomen bestehen. DNA-Ketten heften sich gerne an andere Moleküle; sie sind gewissermaßen klebrig. In den Chromosomen liegt die DNA daher in Form zwei paralleler Stränge vor, deren klebrige Seiten zueinander weisen und die sich wie zwei verdrillte Fäden umeinander winden.
Aptamere sind dagegen einzelsträngig. Diese Tatsache erlaubt es ihnen, Verbindungen mit Molekülen einzugehen, an die herkömmliche DNA normalerweise nicht binden würde, und deren Funktion zu beeinflussen. Das macht sie für die Wirkstoff-Forschung interessant. Zumal sich heute sehr einfach riesige Bibliotheken mit unterschiedlichen Aptameren herstellen lassen. Manche von ihnen enthalten millionenfach mehr potenzielle Wirkstoffe, als Menschen auf der Erde leben. „Wir haben aus einer solchen Bibliothek Aptamere isoliert, die sich an das Spike-Protein des SARS-Coronavirus 2 heften können“, erklärt Prof. Dr. Günter Mayer vom LIMES-Institut (das Akronym steht für „Life and Medical Sciences“) der Universität Bonn.
Spike ist für die Infektion essentiell
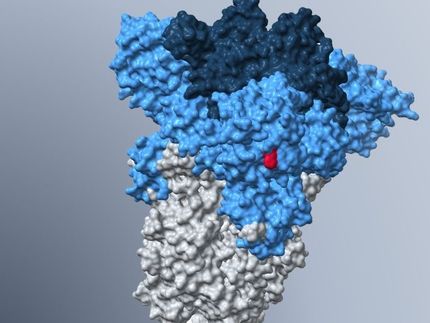
Das Spike-Protein ist für den Erreger essentiell: Mit ihm dockt er an die Zellen an, die er attackiert. Dabei bindet das Protein an ein Molekül auf der Oberfläche seiner Opfer namens ACE2, das gewissermaßen in das Spike-Protein einrastet, ähnlich wie ein Skischuh in der Skibindung. Danach fusioniert das Virus mit der Zelle und programmiert sie so um, dass sie zahlreiche neue Viren produziert. „Die allermeisten Antikörper, die wir heute kennen, verhindern das Andocken“, erläutert Mayer. „Sie heften sich an den Teil des Spike-Proteins, der für die Erkennung von ACE2 zuständig ist - die Rezeptorbindungsdomäne, kurz RBD.“
Das nun isolierte Aptamer mit dem Kürzel SP6 bindet ebenfalls an das Spike-Protein, allerdings an einer anderen Stelle. „Es unterbindet also nicht, dass SARS-CoV2 an seine Zielzelle andockt“, sagt Prof. Dr. Michael Famulok vom LIMES-Institut, der zudem am Forschungszentrum caesar in Bonn arbeitet. „Dennoch unterbleibt danach die Infektion der Zelle - welcher Mechanismus dafür verantwortlich ist, wissen wir noch nicht.“ In ihren Experimenten nutzten die Forscher keine echten Coronaviren, sondern sogenannte Pseudoviren. Diese tragen zwar auf ihrer Oberfläche das Spike-Protein; sie können aber keine Krankheiten auslösen. „Wir müssen nun sehen, ob unsere Ergebnisse sich auch bei echten Viren bestätigen“, betont Famulok daher.
Neue Achillesferse des Coronavirus?
Falls ja, könnten die Arbeiten mittelfristig zum Beispiel in einer Art Nasenspray münden, das einige Stunden gegen eine Corona-Infektion schützt. Allerdings werden die dazu nötigen Studien sicher noch Monate in Anspruch nehmen. Unabhängig davon können die Ergebnisse aber dazu beitragen, die Mechanismen bei der Infektion besser zu verstehen. Das ist umso wichtiger, da die bisherigen Wirkstoffe sich vor allem gegen die Rezeptorbindedomäne richten. Bei der sogenannten „britischen Mutante“ ist diese Domäne verändert, so dass sie stärker an ACE2 andockt. „Je mehr solcher Mutationen sich anhäufen, desto größer wird die Gefahr, dass die verfügbaren Medikamente und Impfstoffe nicht mehr wirken“, betont Günter Mayer. „Unsere Studie könnte den Blick auf eine alternative Achillesferse des Erregers lenken.“
Die Ergebnisse sind auch Ausdruck einer erfolgreichen Kooperation: Mayer und seine Postdoktorandin Dr. Anna Maria Weber waren vor allem für die Charakterisierung des Aptamers zuständig. In der Arbeitsgruppe von Prof. Famulok am Forschungszentrum caesar liefen dagegen unter anderem die Pseudovirus-Versuche, maßgeblich vorangetrieben von seinem Mitarbeiter Dr. Anton Schmitz. Famulok und Mayer sind Mitglieder im Transdisziplinären Forschungsbereichen „Life & Health“ sowie „Building Blocks of Matter and Fundamental Interactions“. Mayer leitet zudem das Center of Aptamer Research and Development (CARD) an der Universität Bonn.