Molekulare Container im Blick
Nano-Verpackungen für medizinische Wirkstoffe können ihre Tücken haben: Belädt man sie zu stark, lösen sie sich nur noch schlecht auf. Warum das passiert, berichtet eine Würzburger Forschungsgruppe in „Angewandte Chemie“.
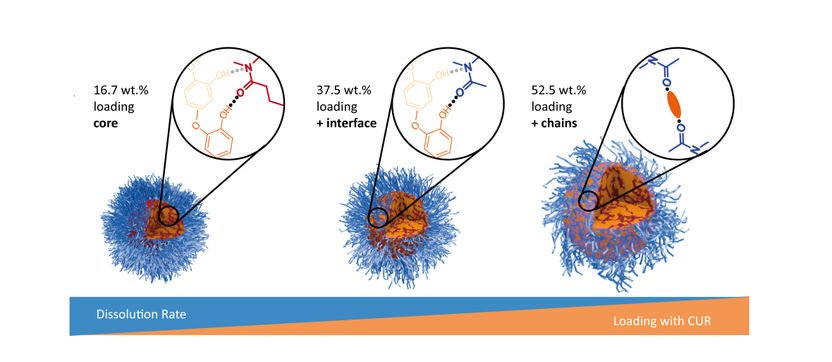
Bei steigender Beladung mit Curcumin (gelb) nimmt die Auflösbarkeit der Wirkstoff-Container aus Polymer-Mizellen (blau) ab.
Ann-Christin Pöppler
Nanokapseln und andere Transport-Container können Medikamente im Körper eines Patienten direkt zum Krankheitsherd bringen und sie dort kontrolliert freisetzen. Solche ausgetüftelten Systeme werden vereinzelt in der Krebstherapie angewendet. Weil sie sehr gezielt wirken, haben sie weniger Nebenwirkungen als Medikamente, die sich im ganzen Organismus verteilen.
Diese Methode der „Wirkstoff-Zustellung“ wird in der Wissenschaft als Drug Delivery bezeichnet. Dass sie noch großes Entwicklungspotenzial birgt, davon ist auch Chemieprofessorin Ann-Christin Pöppler von der Julius-Maximilians-Universität (JMU) Würzburg überzeugt. Ihre Forschung dreht sich um die molekularen Hüllen, die wie ein Container Medikamente umschließen und zum Wirkungsort bringen: „Meine Gruppe will möglichst detailliert verstehen, wie sich die Containermoleküle und die Wirkstoffe anordnen und welche Eigenschaften sich daraus ergeben“, sagt sie.
Polymer-Mizellen als Forschungsobjekte
Die Juniorprofessorin erforscht vor allem Polymer-Mizellen. Diese bestehen aus vielen kettenförmigen Molekülen, die sich zu kugelförmigen Strukturen zusammenlagern. Als Wirkstoff-Container sind solche Mizellen bereits auf dem Markt. Sie werden bei Krebstherapien verwendet, aber auch in kosmetischen Produkten wie Abschmink-Lotionen. Kommen sie mit fettlöslichen Stoffen in Verbindung, ordnen sie sich an deren Oberfläche an und umschließen sie am Ende wie ein Haarkleid. Dabei bildet sich ein Container mit einer „wasserliebenden“ äußeren Hülle und einem „fettliebenden“ Kern.
„Man weiß bislang nur wenig über den Zusammenhang zwischen Struktur und Eigenschaft auf molekularer Ebene“, sagt Pöppler. Im Journal Angewandte Chemie hat die Forscherin mit Co-Autoren aus der JMU kürzlich einen Effekt beschrieben, der für das Design solcher Drug-Delivery-Systeme wichtig ist: Verpackt man steigende Mengen Wirkstoffe in Container aus Polymer-Mizellen, leidet deren Auflösbarkeit darunter – eine Freisetzung der Wirkstoffe wird dadurch erschwert.
Wirkstoffe verkleben die Mizellen
Den Grund für die nachlassende Auflösbarkeit fand das Würzburger Forschungsteam mit Experimenten heraus: Bei steigender Beladung des Containers ordnen sich die Wirkstoffe nicht mehr ausschließlich im Kern an, sondern auch an der Containeroberfläche. Dort können sie die einzelnen Mizellen-Haare regelrecht miteinander verkleben. Diese molekularen Wechselwirkungen setzen die Auflösbarkeit der gesamten Struktur herab.
Als nächstes will das Team klären, ob sich die Auflösbarkeit des Containers mit strukturellen Veränderungen an den Mizellen verbessern lässt. Denn ein Ziel im Drug Delivery heißt: Ein Container soll möglichst große Wirkstoffmengen aufnehmen und sich im Körper bestmöglich auflösen.
Polymerchemie und Pharmazie beteiligt
Bei dieser Arbeit hat Ann-Christin Pöppler mit zwei anderen Arbeitsgruppen der JMU kooperiert. Die Polymer-Mizellen wurden bei Robert Luxenhofer hergestellt, Professor für Polymere Funktionswerkstoffe. Die Auflösungstests liefen im Team von Professor Lorenz Meinel, Inhaber des Lehrstuhls für Pharmazeutische Technologie und Biophysik.
Bei den verwendeten Polymer-Mizellen handelte es sich um Verbindungen aus der Substanzklasse der Poly(2-Oxazoline) und der Poly(2-Oxazine). Als Modell für einen Wirkstoff kam Curcumin zum Einsatz – denn dieser Inhaltsstoff der Gelbwurzel, einer Gewürzpflanze, lässt sich spektroskopisch sehr gut darstellen. Die Strukturen der mit unterschiedlichen Curcumin-Mengen beladenen Container wurden mit Festkörper-NMR-Spektroskopie und weiteren Analysemethoden ermittelt.
Originalveröffentlichung
"Loading-dependent Structural Model of Polymeric Micelles Encapsulating Curcumin by Solid-State NMR Spectroscopy"; Ann-Christin Pöppler, Michael M. Lübtow, Jonas Schlauersbach, Johannes Wiest, Lorenz Meinel, Robert Luxenhofer; Angewandte Chemie; 2019