„Artenbildung“ bei Proteinen zum Schutz gegen DNA-Parasiten
Forscher am IMBA – Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften – decken in zwei aktuellen Publikationen auf, wie sich Zellen gegen Genom-Parasiten schützen. Erkenntnisse daraus werfen neues Licht auf die „molekulare Evolution“ von Proteinen und das Wettrüsten zwischen Zellen und DNA Eindringlingen.
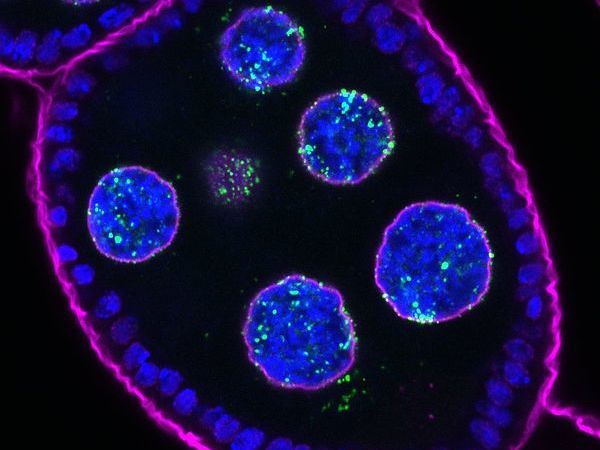
An egg chamber of a Drosophila melanogaster ovary expressing Nxf3 tagged with GFP (in green). Nxf3 localizes to piRNA source loci the nucleus as well as piRNA processing sites in the cytoplasm. DNA is stained in blue, while the nuclear pore marker (WGA) is in magenta.
(c) IMBA
Wäre unsere DNA ein Buch, so hätte es eine Million Seiten mit 3 Milliarden Buchstaben, die aneinander gereiht etwa 9.000 km lang wären. Doch nur ein Bruchteil davon – beim Menschen sind es rund 5 % - sind bekannte Gene mit der Gebrauchsanleitung für Proteine. Ein wesentlich größerer Anteil unseres Genmaterials stammt ursprünglich von Genomparasiten, die sich im Laufe der Evolution in unserem Erbgut angesammelt haben. Diese egoistischen Gene und ihre evolutionären Überreste machen rund die Hälfte unserer DNA aus. Wie der Name verrät, folgen egoistische Gene dabei ihrer eigenen Strategie und kümmern sich nur um ihre eigene Vervielfältigung. Verstreut in den Genomen von Pflanzen, Pilzen und Tieren können diese genetischen Parasiten von einer Position in der DNA zur anderen springen. Damit schaffen sie zwar genetische Vielfalt, was bei evolutiven Anpassungsprozessen wichtig ist. In den meisten Fällen richten die springenden Genomparasiten jedoch großen Schaden für den Organismus an und können mitunter zur Unfruchtbarkeit führen.
piRNAs - Beschützer des Genoms
Glücklicherweise weiß sich unser Genom zu schützen: So wie Bakterien mithilfe der kürzlich entdeckten Genschere CRISPR/Cas eindringende Viren identifizieren und zerstören, so haben auch unsere Zellen verschiedene Strategien zum Schutz des Genoms entwickelt. Eine große Rolle dabei spielen winzig kleine RNAs, welche es Zellen ermöglichen, fremde von eigener DNA zu unterscheiden. Gezielt erkennen die kleinen RNAs die egoistischen Passagen im Erbgut, docken daran an und erlauben so ein gezieltes Stilllegen dieser Bereiche. Diese sogenannten piRNAs funktionieren also wie eine Art Immunsystem für das Genom.
Die Produktion der kleinen piRNAs ist jedoch alles andere als gewöhnlich. Verschiedene Schritte der piRNA- Herstellung werden an verschiedenen Orten in der Zelle erledigt. Dabei müssen die längeren Vorläufer RNAs von ihren Produktionsstätten im Kern ins Zellplasma transportiert werden, wo sie dann zurechtgeschnitten werden. Von der Hefezelle bis zum Menschen sorgt ein bekanntes Protein namens Nxf1 (oder Nuclear Export Factor 1) für den üblichen RNA-Export. Damit eine Ausreise ins Zellplasma erfolgen kann, müssen RNAs normalerweise einen strengen Security Check passieren. Die piRNA Vorläufer aber sind anders als übliche RNAs. Ihnen fehlen viele der Qualitätsmerkmale normaler zellulärer RNAs und daher würden sie bei der üblichen „Passkontrolle“ aufgehalten werden. Dennoch schaffen sie ihren Weg ins Zellplasma, indem sie die üblichen Exportwege umgehen und sich „schmuggeln“ lassen.
Dabei hilft ihnen ein Protein namens Nxf3. Es stammt aus derselben Proteinfamilie wie Nxf1, das für den normalen RNA Export zuständig ist. Nxf3 aber hat eine komplett neue Funktion übernommen, wie die Forschungsgruppe rund um Julius Brennecke aktuell im Fachmagazin Cell berichtet. „Für die alternative Export-Route der piRNAs werden Histonproteine, die eigentlich für die Verpackung von DNA zuständig sind, mit chemischen Signalen versehen und dadurch anders gelesen. So kommt es, dass ein Protein mit dem vielversprechenden Namen Bootlegger zusammen mit Nxf3 die piRNAs auf einer alternativen Ausreise-Route aus dem Zellkern in das Zellplasma bringt. „Dabei werden vorschriftsmäßige Wege umgangen und neue, epigenetisch gesteuerte Routen erschlossen. Interessant dabei ist, dass sich die Zelle dabei bereits vorhandener Bausteinen bedient, um neue Signalwege zu bauen,“so Peter Andersen, Erstautor der Publikation, der diesen Mechanismus gerne mit den bekannten „IKEA-Hacks“ vergleicht.
„Artenbildung“ unter Proteinen
In einer zweiten Publikation im Fachmagazin Nature Structural and Molecular Biology wurde ein weiteres Protein aus der NXF Familie unter die Lupe genommen. Nxf2 hat zum Überraschen der Forscher keinerlei Exportfunktion für RNAs beibehalten, sondern hat sich in der Zelle auf die Bildung von Heterochromatin, also der dichten Verpackung von DNA spezialisiert. „Es ist das erste Mal, dass gezeigt werden konnte, dass ein RNA Export Protein eine derart unterschiedliche Aufgabe im Gegensatz zu seiner ursprünglichen Funktion übernimmt,“erklärt Julia Batki, die zusammen mit Jakob Schnabl im Rahmen ihrer Dissertation am Vienna BioCenter PhD Program den piRNA Signalweg erforscht.
Generell werden in der Natur bereits vorhandene Strukturen häufig je nach Bedarf umfunktioniert. Die Forscher konnten diesen Prozess nun auch auf die molekulare Ebene übertragen. Denn auch hier passiert „Artenbildung“ - verschiedene Proteine mit verschiedenen Funktionen stammen alle von einem Vorfahren ab. „Wir konnten nachweisen, dass der piRNA Export in der Zelle auf einer neu erschlossenen Route funktioniert. Das ist insofern interessant, weil sich vielleicht auch Retroviren, die eine große Zahl verschiedenartiger Krankheiten, darunter Tumoren, Neurologische Erkrankungen und Immunschwächen auslösen können, vermutlich ähnlicher Strategien bedienen, um den „Sicherheitscheck“ bei der Ausreise aus dem Zellkern zu umgehen erklärt Forschungsgruppen-Leiter Julius Brennecke.