Aus dem Meer ins Labor
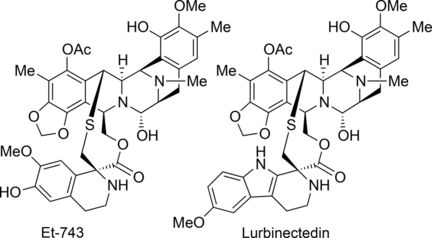
Totalsynthese der marinen Antitumorwirkstoffe Trabectedin und Lurbinectidin
Anzeigen
Das Meer und seine riesige Zahl und Vielfalt an Lebewesen sind ein noch weitgehend unerforschter Fundus für Naturstoffe, die Ausgangspunkt für neue wirksame Pharmaka sein können, wie die Antitumormittel Trabectedin und Lurbinectidin. Aufgrund der nur sehr geringen Mengen, die aus Meeresorganismen gewonnen werden können, ist eine synthetische Herstellung unabdingbar. In der Zeitschrift Angewandte Chemie stellen Wissenschaftler jetzt eine neue, effiziente und skalierbare Syntheseroute für diese beiden Wirkstoffe vor. Schlüsselschritt ist die lichtgesteuerte Aktivierung einer C-H-Bindung.
© Wiley-VCH
Trabectedin (auch als Ecteinascedin bezeichnet) stammt aus der Seescheide Ecteinascidia turbinata und ist das erste marine Naturprodukt, das klinisch als Wirkstoff eingesetzt wird: Bei der Behandlung von fortgeschrittenem Weichteilsarkom. Das strukturell leicht abgewandelte Lurbinectedin befindet sich derzeit in der Phase III der klinischen Studien für eine Behandlung bestimmter Lungen- und Brustkrebstypen. Eine Tonne der Seescheiden wird benötigt, um etwa 1 g Trabectedin zu gewinnen. Eine praktikable, effiziente Syntheseroute, um diesen und verwandte Wirkstoffe in ausreichend hoher Menge herstellen zu können, wird daher dringend benötigt. Trabectedin hat sich jedoch als eines der herausforderndsten Zielmoleküle der Naturstoffsynthese erwiesen. Verschiedene Syntheserouten wurden vorgeschlagen – allerdings war bisher keine wirklich praktikabel. Aktuelle Verfahren sind sehr aufwendig, basieren auf kostenintensiven, wenig gebräuchlichen Reagenzien und liefern unbefriedigende Ausbeuten.
Die Forscher um Dawei Ma vom Shanghai Institute of Organic Chemistry (China) beschreiben jetzt eine effizientere und praktikablere de novo-Route für die Synthese von Trabectedin und Lurbinectidin. De novo oder auch Totalsynthese bedeutet, dass Naturstoffe ausgehend von kleinen, gängigen Ausgangsstoffen komplett neu aufgebaut werden.
Die Synthese besteht aus 26 einzelnen Schritten ausgehend von der Aminosäure S-Tyrosin. Zunächst wird in mehreren Schritten eine Zwischenstufe hergestellt, die dann Startpunkt für die – getrennte – Herstellung beider Hälften der Zielmoleküle bildet, die in einem späteren Reaktionsschritt miteinander verknüpft werden.
Schlüsselschritt der Synthese ist die lichtgesteuerte Aktivierung einer normalerweise nicht reaktiven Kohlenstoff-Wasserstoff-Bindung („Remote C–H Bond Activation“). Über einen radikalischen Umlagerungsmechanismus kommt es zu einem Ringschluss, bei dem eine Chinon-Gruppe in eine 1,3-Benzodioxol-Gruppe umgewandelt wird, eine in vielen Naturstoffen vorkommende Strukturkomponente. Besonders effektiv lief die Reaktion unter Bestrahlung mit blauem Licht in Tetrahydrofuran als Lösungsmittel.
Die Wissenschaftler hoffen, dass ihre Syntheseroute einen praktischen und ökonomischen Ansatz für die Herstellung von Trabectedin und Lurbinectidin liefert und so endlich eine ausreichende Versorgung mit diesen komplexen marinen Antitumorwirkstoffen ermöglichen könnte.























































