Lebenszeit von Proteinen im Gehirn messbar
Neu entwickelte, quantitative Methode von Göttinger Forschern ermöglicht erstmals, die Lebenszeit von Proteinen im Gehirn zu bestimmen und Rückschlüsse auf die Zusammensetzung des zugehörigen Gens zu ziehen.
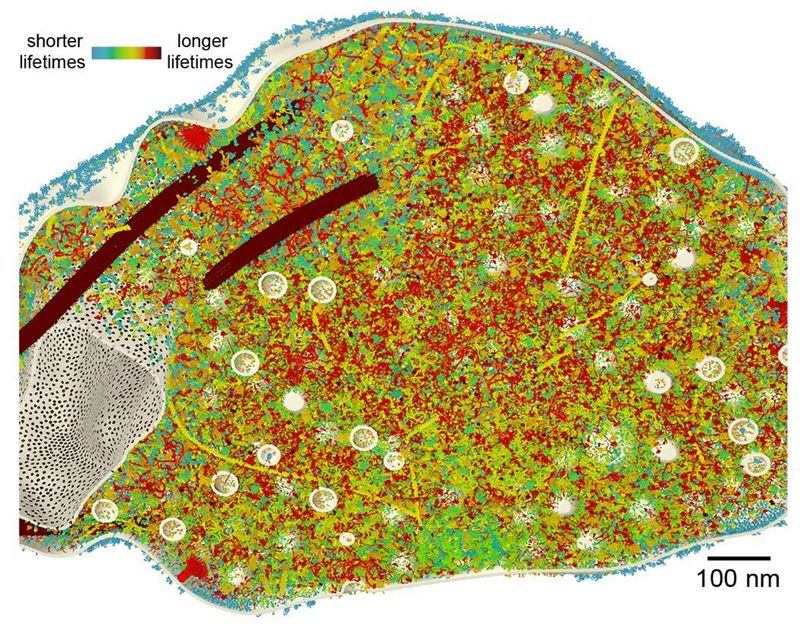
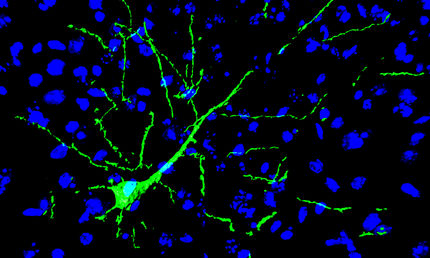
Das 3D-Modell eines synaptischen Endköpfchens zeigt im Anschnitt die Proteine in ihrer entsprechenden Kopienzahl in der Synapse. Die farbliche Darstellung verdeutlicht die unterschiedlichen Lebenszeiten der Proteine (rot: langlebiger; blau: kurzlebig).
cnmpb/rizzoli
Eines der großen Ziele in den Neurowissenschaften ist es zu verstehen, wie Wahrnehmung, Lernen und Verhalten durch die Aktivität des Gehirns zustande kommen. Dafür ist es wichtig, physiologische Prozesse im Detail zu verstehen, die grundlegend für die Steuerung der Hirnfunktionen sind. Dazu gehört, die Eigenschaften der molekularen Bausteine des Gehirns – die Proteine – näher zu untersuchen und zu verstehen, wie sie ersetzt oder ihre Funktionalität über ihre Lebenszeit erhalten werden kann. Gibt es Proteine im Gehirn, die länger leben als andere? Beeinflusst die Hirnaktivität vielleicht die Stabilität der Proteinbausteine? Und inwiefern sind diese Mechanismen bei neurodegenerativen Demenz-Erkrankungen gestört?
Um diese und weitere Fragen zu beantworten, haben sich Wissenschaftler der Universitätsmedizin Göttingen (UMG), des Max-Planck-Instituts für biophysikalische Chemie (MPI-BPC), des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) und des Instituts für Medizinische Systembiologie in Hamburg zusammen-geschlossen. Unter Leitung von Prof. Dr. Silvio O. Rizzoli vom Exzellenzcluster für Mikroskopie im Nanometerbereich und Molekularphysiologie des Gehirns (CNMPB) der UMG und Prof Dr. Henning Urlaub (UMG, MPI-BPC) entwickelte das Team eine neue Methode zur präzisen Bestimmung der Stabilität von Proteinen im Mäusehirn.
Erstmals gelang es damit Dr. Eugenio F. Fornasiero vom Institut für Neuro- und Sinnesphysiologie, UMG, und Kollegen, die verschiedenen Lebenszeiten von mehr als 3.500 verschiedenen Proteinen im Gehirn zu beschreiben. Die hohe Präzision dieser Methode macht es zudem möglich, Proteine im Gehirn und in Nervenzellen in ganz spezifischen Bereichen und auch in Abhängigkeit des physiologischen Zustandes zu erfassen. Basierend auf den Ergebnissen dieser Studie gelang es den Wissenschaftlern in einer Folgestudie, Faktoren zu analysieren, die die Proteinstabilität beeinflussen. Dabei konnten sie zeigen, dass schon die Zusammensetzung der Gene Einfluss auf die Proteinstabilität hat.
Diese Erkenntnisse könnten zukünftig dazu beitragen, die grundlegenden Prinzipien der Proteinstabilität besser zu verstehen und neurodegenerative Erkrankungen zu erforschen. Um die zukünftige Forschung zur Entschlüsselung von Krankheitsmechanismen, die auf krankhaften Veränderungen der Lebensdauer von Proteinen beruhen, zu unterstützen, werden die Ergebnisse der Wissenschaft frei zur Verfügung gestellt.
Eine Veränderung der Lebenszeit eines bestimmten Proteins kann ein Anhaltspunkt dafür sein, dass sich seine Funktion verändert hat. Die Wissenschaftler konzentrierten sich daher insbesondere auf die Entwicklung einer Methode, die Untersuchungen der Proteinstabilität in den Synapsen von Nervenzellen ermöglicht. Über diese feinen Verästelungen sind die Nervenzellen im Gehirn untereinander vernetzt und kommunizieren miteinander. Bei neurodegenerativen Erkrankungen bilden fehlgefaltete Proteine Verklumpungen mit toxischer Wirkung, die sich in oder zwischen Nervenzellen ablagern. Die Synapsen degenerieren und die Nervenzellen sterben ab.
Der neu entwickelte Ansatz für hirnphysiologische Untersuchungen eröffnet jetzt die Möglichkeit, die Entstehung neurodegenerativer Erkrankungen aus einer neuen Perspektive zu betrachten und darauf aufbauend die Entwicklung neuer therapeutischer Strategien voranzutreiben. Auch für die Entschlüsselung anderer Krankheitsmechanismen, die auf krankhaften Veränderungen der Lebensdauer von Proteinen beruhen, wie beispielsweise die Herzschwäche, ist die Anwendung dieser neuen Methode vielversprechend.
Originalveröffentlichung
Fornasiero EF, Mandad S, Wildhagen H, Alevra M, Rammner B, Keihani S, Opazo F, Urban I, Ischebeck T, Sakib MS, Fard MK, Kirli K, Centeno TP, Vidal RO, Rahman RU, Benito E, Fischer A, Dennerlein S, Rehling P, Feussner I, Bonn S, Simons M, Urlaub H, Rizzoli SO; "Precisely measured protein lifetimes in the mouse brain reveal differences across tissues and subcellular fractions"; NAT COMMUN; 2018, 9: 4230.
Mandad S, Rahman R-U, Centeno TP, Vidal RO, Wildhagen H, Rammner B, Keihani S, Opazo F, Urban I, Ischebeck T, Kirli K, Benito E, Fischer A, Yousefi RY, Dennerlein S, Rehling P, Feussner I, Urlaub H, Bonn S, Rizzoli SO, Fornasiero EF; "The codon sequences predict protein lifetimes and other parameters of the protein life cycle in the mouse brain"; SCI REP; 2018; 8: 16913.