Zelluläres Gedächtnis überlistet Krankheitskeime
Studie belegt Wirksamkeit der sequentiellen Antibiotika-Therapie gegen Pseudomonas aeruginosa
Anzeigen
Die Weltgesundheitsorganisation WHO warnt davor, dass sich scheinbar harmlose Bakterieninfektionen in den nächsten Jahren zu einer der häufigsten Todesursachen vor allem in den Industrienationen entwickeln könnten. Diese dramatische Bedrohung ist entstanden, weil die seit Jahrzehnten als Standardtherapie verschriebenen Antibiotika in vielen Fällen durch sich ausbreitende Resistenzen wirkungslos geworden sind und diese Entwicklung mit zunehmender Geschwindigkeit weitergeht. Ursache des Problems ist die Fähigkeit der Keime zur schnellen evolutionären Anpassung an die eingesetzten Wirkstoffe. Die Konsequenz ist, dass selbst neue Antibiotika innerhalb kurzer Zeit ineffektiv werden können. Daher verfolgen Forschende weltweit einen alternativen Ansatz, um in der sich zuspitzenden Antibiotika-Krise die Oberhand zurückzugewinnen. Sie versuchen durch die Anwendung evolutionsbiologischer Prinzipien die Wirksamkeit der aktuell vorhandenen Wirkstoffe länger zu erhalten. Ein Forschungsteam des Kiel Evolution Center (KEC) an der Christian-Albrechts-Universität zu Kiel (CAU) hat gemeinsam mit Kollegen am Max-Planck-Institut für Evolutionsbiologie in Plön und der schwedischen Universität Uppsala dazu ein bisher unbekanntes Prinzip aufgedeckt, das eine komplett neue und gleichzeitig höchst nachhaltige Therapieform ermöglicht.
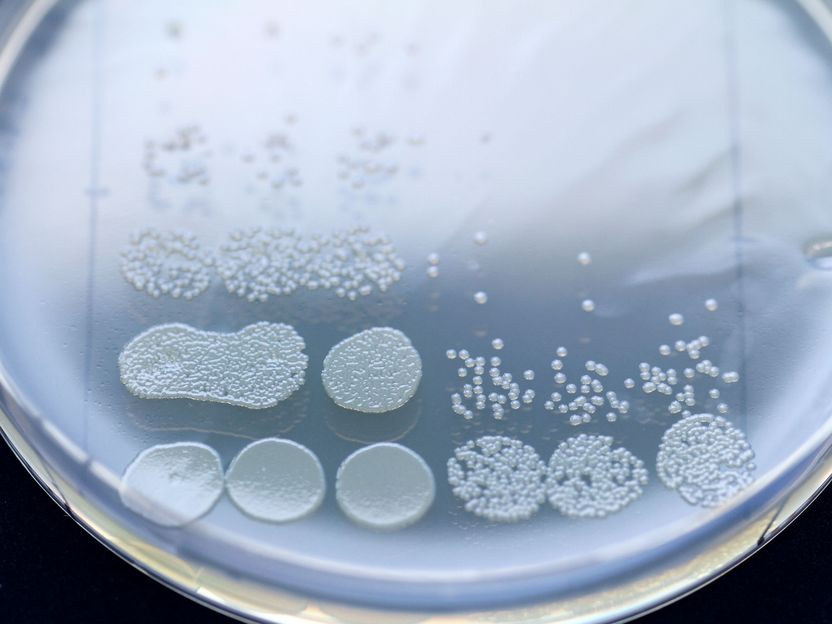
Kurze Vorbehandlung mit einem Penizillin erhöht die Wirksamkeit eines nachfolgenden Aminoglykosids. Gezeigt ist eine Verdünnungsreihe einer Bakterienprobe nach Ende der Behandlung, entweder ohne (3 Spalten links) oder mit Vorbehandlung (3 Spalten rechts).
© Christian Urban, Uni Kiel
Das untersuchte Behandlungsverfahren macht sich ein simples Prinzip zunutze: Auf die kurze, impulsartige Gabe eines bestimmten Präparats folgt anschließend die Anwendung eines Antibiotikums mit einer anderen Wirkungsweise. Am Beispiel des Bakteriums Pseudomonas aeruginosa, das laut WHO zu den kritischsten Keimen mit multiplen Resistenzen gehört, erprobten die Kieler Forschenden diese abwechselnde Gabe unterschiedlich wirkender Medikamente. Dazu untersuchten sie in einem Evolutionsexperiment rund 200 Bakterienpopulationen über insgesamt 500 Generationen und beobachteten, wie sich verschiedene Antibiotika und ein geändertes zeitliches Schema der Medikamenten-Wechsel auswirkten. Dabei fanden sie heraus, dass besonders die Abfolge eines Penicillin-ähnlichen Wirkstoffs und eines sogenannten Aminoglykosids und der schnelle Wechsel mit zufälligen Intervallen besonders gut wirkten.
„Ein kurzer einleitender Behandlungsimpuls macht den Keim anfällig, weil er das Eindringen weiterer Medikamente in die Bakterienzellen erleichtert. Das zweite Antibiotikum erledigt gewissermaßen den Rest und tötet die verbleibenden Krankheitserreger zuverlässig ab“, erklärt Professor Hinrich Schulenburg, Leiter der Arbeitsgruppe Evolutionsökologie und Genetik an der CAU und KEC-Sprecher. Diese Wirkung ist entscheidend von der Reihenfolge des Medikamenten-Wechsels abhängig. Das impulsgebende Präparat muss zuerst wirken, da es in die Struktur der Zellwände des Bakteriums eingreift und so das Einfallstor für den zweiten Wirkstoff öffnet. Zudem sind die Geschwindigkeit und das Muster der Sequenz ausschlaggebend: „Wechselt man die beiden Medikamente schneller als in der üblichen Antibiotikatherapie und in zufälligen Abständen, lässt sich die Bildung der gefürchteten Resistenzen am deutlichsten hemmen“, so Schulenburg weiter.
Ursächlich für den Erfolg der Sequenzbehandlung ist das sogenannte zelluläre Gedächtnis der Krankheitserreger. Durch das erste Antibiotikum werden die zellulären Eigenschaften der Keime über mehrere Generationen hinweg so verändert, dass das zweite Antibiotikum auch mit Verzögerung besser wirken kann. „Durch das erste Antibiotikum wird quasi eine Tür geöffnet, die dem zweiten Antibiotikum leichteren Eintritt verschafft“, erläutert Dr. Roderich Römhild, wissenschaftlicher Mitarbeiter in der Arbeitsgruppe Evolutionsökologie und Genetik und Erstautor der Veröffentlichung. „Dieser Ansatz ist aus evolutionärer Sicht besonders vielversprechend, da die Keime nun gezwungen werden, eine Abwehr gegen das Öffnen der Tür und somit den zellulären Gedächtniseffekt zu entwickeln – anstelle von direkter Resistenz gegen das Antibiotikum“, so Römhild weiter. Im Experiment konnte eine geringere Resistenzentstehung in überzeugender Form bestätigt werden.
Erstaunlich ist, dass bereits vor rund 30 Jahren durch Zufall exakt der nun vorgeschlagene Behandlungsmodus an Patientinnen und Patienten ausprobiert wurde – mit beeindruckendem Erfolg: In fast allen Fällen konnte der untersuchte Krankheitserreger nach der sequentiellen Antibiotika-Behandlung stark reduziert werden; bei der Hälfte war er nicht mehr nachweisbar, und das Verfahren zeigte sich somit deutlich wirksamer als die Standardtherapie. Allerdings fand die Methode nie Eingang in den medizinischen Behandlungsalltag, weil eine Erklärung für den Therapieerfolg fehlte. „Wir sind überzeugt, dass wir mit unseren Ergebnissen zum zellulären Gedächtniseffekt die fehlende Erklärung nun gefunden haben“, betont Schulenburg. „Die neue Arbeit liefert ein weiteres Beispiel dafür, wie mit Hilfe von evolutionsbiologischen Konzepten und Methoden komplett neue Erkenntnisse für nachhaltige Therapieansätze gewonnen werden können“, fasst der KEC-Sprecher zusammen.