Wie Moleküle den Embryo vermessen
Anzeigen
Früh in ihrer Entwicklung können Embryonen den Verlust von Gewebe noch unbeschadet verkraften: Entfernt man einen Teil ihrer Zellen, entwickeln sie sich zu zunächst kleineren, aber kompletten und lebensfähigen Organismen. Forscher des Friedrich-Miescher-Laboratoriums der Max-Planck-Gesellschaft in Tübingen wollten verstehen, wie das molekulare System funktioniert, das die Proportionen im Embryo konstant hält. Gemeinsam mit Wissenschaftlern der Harvard University konnten sie zeigen, dass zwei Moleküle durch ihre entgegengesetzten Funktionen ein System bilden, das sich an die Gesamtgröße des Embryos anpasst.
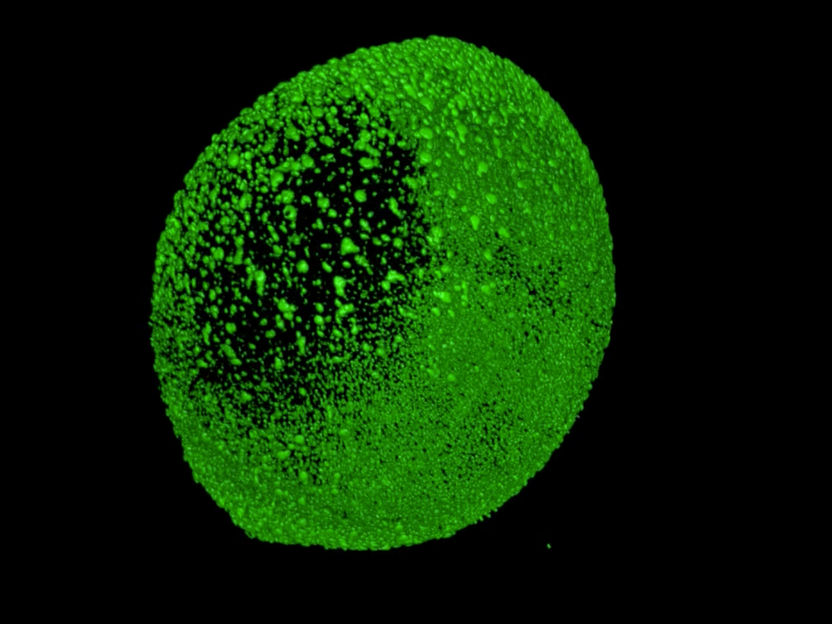
Zebrafischentwicklung im Lichtblattmikroskop. Zu sehen sind die leuchtenden Kerne (mit grün fluoreszierendem Protein markierte Histone) aller Zellen.
© Friedrich-Miescher-Laboratorium/Müller, Marcon
Die Beobachtung, dass die Embryonen einiger Tierarten sich selbst dann normal entwickeln, wenn man sie mechanisch zerteilt, machten Forscher bereits an der Schwelle zum 20. Jahrhundert – und legten damit die Grundsteine für unser heutiges Verständnis embryonaler Entwicklung. Denn diese Experimente zeigten, dass die Entwicklung in verschiedene Gewebe durch anpassungsfähige Prozesse gesteuert sein muss.
Heute wissen wir, dass diese Prozesse von bestimmten Signal-Molekülen, sogenannten Morphogenen, abhängig sind. Wie diese allerdings auf unterschiedliche Gegebenheiten reagieren, um die Musterbildung im Embryo entsprechend anzupassen, untersuchten nun Forscher des Tübinger Friedrich-Miescher-Laboratoriums. „Die Motivation für unsere jetzige Arbeit war es, diese alten entwicklungsbiologischen Beobachtungen mit modernen quantitativen Methoden und mathematischen Modellierungen neu aufzuarbeiten, um die zugrunde liegenden Mechanismen aufzudecken.“, sagt Dr. Patrick Müller, leitender Autor der Studie.
Die Forscher legten den Fokus dabei auf das Morphogen mit dem Namen „Nodal“ und seinen Gegenspieler „Lefty“. Diese beiden Moleküle steuern gemeinsam die Aufteilung des embryonalen Gewebes in drei verschiedene Zellschichten, den sogenannten Keimblättern (Endoderm, Mesoderm und Ektoderm). Diese Aufteilung ist einer der frühesten Schritte der embryonalen Musterbildung und entspricht der Unterscheidung in Innen, Mitte und Außen. Das Signal für „Innen“ gibt dabei Nodal: Dort, wo es am aktivsten ist, entwickeln sich die Zellen zu Endoderm, wo sein Signal schwächer ist, zu Mesoderm. Dort, wo Nodal durch Lefty unterdrückt wird, bildet sich Ektoderm. Bei einem solchen Zusammenspiel spricht man von einem Aktivator-Inhibitor-System.
Um zu untersuchen, ob dieses Aktivator-Inhibitor-System die Musterbildung auch in unterschiedlich großen Embryonen zuverlässig steuern kann, entfernten die Wissenschaftler etwa ein Drittel der Zellen von Zebrafisch-Embryonen, vor allem aus dem Bereich des späteren Ektoderms. Mit RNA-Sonden konnten sie sichtbar machen, wie die verbliebenen Zellen ihre Genexpression anpassten: Die Anteile an späterem Mesoderm und Endoderm verringerten sich innerhalb von nur zwei Stunden und passten sich so an die neue Größe an. Die Verteilung der Nodal-Signalaktivität veränderte sich sogar noch schneller – ein Indiz dafür, dass es für die beobachtete Anpassung verantwortlich ist.
Einen möglichen Mechanismus, wie das System aus Nodal und Lefty auf Änderungen der Gesamtgröße reagieren könnte, lieferte eine Computeranalyse: Das mathematische Model berücksichtigte alle experimentell bekannten Interaktionen und Eigenschaften der Moleküle. Unter den – über 400.000 – möglichen Konstellationen der unbekannten Parameter suchte es nach denjenigen, bei denen die Proportionen im Embryo im Vergleich zur Gesamtgröße konstant bleiben. Das Screening ergab, dass das System vermutlich dadurch auf die Größe des Embryos reagiert, indem die Konzentration von Lefty in kleineren Embryonen ansteigt: Dadurch schränkt es die Aktivität von Nodal stärker räumlich ein, und die Ausdehung von Endoderm und Mesoderm nimmt ab.
Die Forscher überprüften diese Vermutung experimentell – und konnten zeigen, dass die Voraussage des Computermodells den realen Vorgängen entspricht. Ihr komplexes Computermodell lieferte somit die Erklärung für eine jahrhundertalte entwicklungsbiologische Beobachtung. Die Ergebnisse lenken das Augenmerk auch auf ein weit verbreitetes biologisches Prinzip, denn auch in Einzellern scheint es Steuerungsprozesse zu geben, bei denen Größe und Molekülkonzentration gekoppelt sind. Diese Mechanismen scheinen eine ubiquitär vorkommende biologische Strategie zur Kontrolle von Größe und Differenzierung zu sein.