Ein Fingerabdruck für Gene
Max-Planck-Wissenschaftler entwickeln neue Strategie, die künftig wichtige Rolle bei der Erforschung von Krankheiten spielen wird
Anzeigen
Zellen haben zwar keinen Mund, müssen aber trotzdem Stoffe aus der Außenwelt aufnehmen. Ist dieser als Endozytose bezeichnete Vorgang gestört, können Erkrankungen wie Krebs, Morbus Huntington oder Diabetes entstehen. Auch Krankheitserreger können auf diesem Weg in die Zelle gelangen. Wissenschaftler vom Max-Planck-Institut für molekulare Zellbiologie und Genetik haben deshalb in Kooperation mit dem Zentrum für Informationsdienste und Hochleistungsrechnen (ZIH) an der TU Dresden mit einer neuen Strategie untersucht, welche Gene an der Aufnahme von Stoffen in die Zelle beteiligt sind, und welche Funktion sie dabei haben. Eine Kombination aus hochauflösender Mikroskopie und quantitativer Bildanalyse ermöglichte den Forschern, die Auswirkungen einer Vielzahl von Genen auf die Endozytose zu untersuchen. Die Wissenschaftler erhoffen sich von den Ergebnissen auch wichtige Erkenntnisse darüber, wie künftig Infektionen verhindert und Erkrankungen behandelt werden könnten.
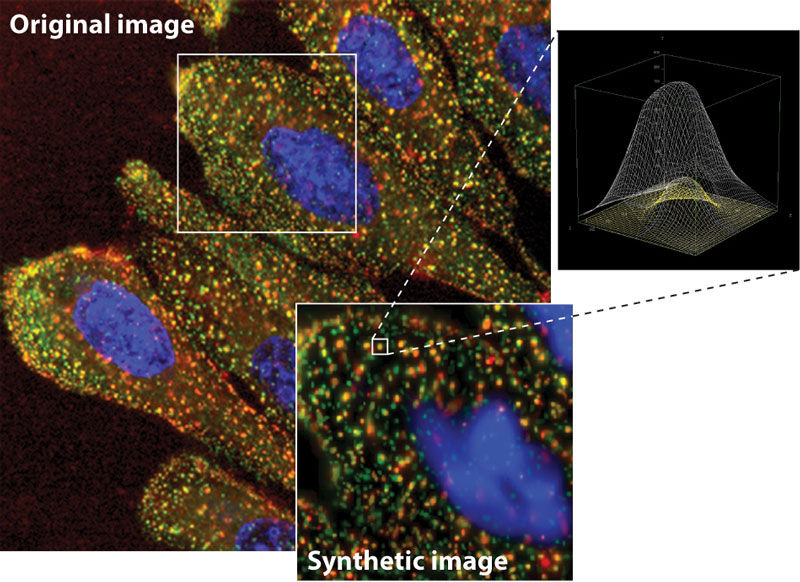
Zellen mit rot und grün eingefärbten Endosomen sowie markierten Zellkernen (blau). Aus der Leuchtintensität der markierten Zellorganellen wird ein synthetisches Abbild geformt (kleines Bild unten). Zu sehen ist auch das berechnete 3D-Modell eines einzelnen Endosoms (kleines Bild rechts oben).
Max-Planck-Gesellschaft
Zellen nehmen Fremdmaterial auf, indem sie Bläschen von ihrer Zellmembran abschnüren, die in ihrem Innern Substanzen von außen einschließen. Je nach Inhaltsstoff werden diese Vesikel - auch Endosomen genannt - an unterschiedliche Orte innerhalb der Zelle transportiert und dort weiter verarbeitet bzw. abgebaut. Auch Bestandteile der Zellmembran selbst gelangen auf diesem Endosomen-Fließband ins Zellinnere. Verschieden spezialisierte Vesikel bilden somit ein kompliziertes Transport-Netzwerk, über das eine Vielzahl von Substanzen ihren Bestimmungsort erreicht. Wie im Detail jedoch beispielsweise Bestandteile des Zellkerns oder der Zellmembran zu ihren jeweiligen Bestimmungsorten gelangen, ist bislang weitgehend unbekannt.
Die neue Untersuchungsstrategie offenbarte den Wissenschaftlern bislang ungeahnte Einblicke in die hoch komplizierten Prozesse, die während der Endozytose ablaufen. So haben sie auf ihren Aufnahmen entdeckt, dass der Ausfall bestimmter Gene dazu führt, dass Vesikel in der Peripherie der Zellen stecken bleiben und nicht ins Zentrum transportiert werden. Zudem werden unterschiedliche Stoffe offenbar teilweise von anderen Genen an ihr Ziel dirigiert. Gesteuert wird die Endozytose mit Hilfe verschiedener Signalwege. Gleichzeitig nutzen die Zellen sie, um die Menge von Signalmolekülen im Innern oder in der Zellmembran anzupassen - Endozytose und Signalbahnen beeinflussen sich also gegenseitig. Alles in allem sind über 4.000 Gene direkt oder indirekt an der Endozytose beteiligt. "Unsere Ergebnisse zeigen, dass Zellen nicht einfach drauf los futtern und mehr oder wenig beliebig Stoffe aufnehmen. Sie legen vielmehr ganz genau fest, was sie wann in welchen Mengen benötigen und wohin es in der Zelle geschafft werden soll", sagt Marino Zerial, Direktor am Max-Planck-Institut für molekulare Zellbiologie und Genetik.
Gestörte Endozytose kann krank machen
Die enorme Anzahl an beteiligten Genen spiegelt auch die Bedeutung der Endozytose im Organismus wider. So hängt nicht nur die Bildung wichtiger Stoffwechselprodukte wie z.B. Insulin von der Endozytose ab, sondern auch Viren nutzen Endosomen, um Zellen zu infizieren. Immunzellen wiederum verschlingen Krankheitserreger und verdauen sie in Vesikeln. Gefährliche Infektionen könnten also eines Tages möglicherweise verhindert werden, wenn es gelänge, die Endozytose von Viren und Bakterien zu unterbinden. Auch Erkrankungen wie Alzheimer oder Morbus Huntington hängen mit einem gestörten Transportsystem in Zellen zusammen, denn schädliche Proteine können dadurch nicht mehr aus Nervenzellen entfernt werden. Wenn also die Rolle der verschiedenen Gene bei der Endozytose bekannt ist, können in Zukunft leichter Behandlungsmöglichkeiten gegen diese Erkrankungen entwickelt werden.
Dank der neuen Technik aus Dresden wird dies künftig sehr viel einfacher sein. Denn die Max-Planck-Forscher konnten exakt messen, welche Rolle Gene an einem bestimmten Ablauf in einer Zelle spielen. Dazu werteten sie Mikroskopiebilder anhand Dutzender verschiedener Parameter quantitativ aus und ordneten jedem Gen eine bestimmte Funktion in dem Prozess zu. "Wir haben die Aktivität aller Gene abgetastet und abgebildet. So konnten wir von jedem Gen ein quantitatives Profil erstellen - jedes Gen erhält also quasi einen individuellen Fingerabdruck. Das gibt uns ein weitaus umfassenderes Verständnis davon, wie die verschiedenen Abläufe in der Zelle zusammen wirken. Wir sind auf dem richtigen Weg, eine "virtuelle Zelle" zu schaffen, in der wir alle Prozesse und Wechselwirkungen modellhaft verstehen", erklärt Marino Zerial.
Neue Therapien verlangen nach neuen Untersuchungsstrategien
Möglich gemacht hat dies eine Kombination mehrer Techniken. Die Dresdner Wissenschaftler blockierten nacheinander jedes der rund 24.000 menschlichen Gene mit Hilfe von RNA-Molekülen (siRNAs), die sich an bestimmte Abschnitte im Erbgut anlagern und das zugehörige Gen stumm schalten. Als nächstes markierten sie zwei Proteine, die von den untersuchten Zellen in Vesikel aufgenommen werden, mit Fluoreszenzfarbstoffen und machten sie so für eine automatisierte Bildanalyse-Software sichtbar. Anstatt die Mikroskop-Aufnahmen subjektiv und anhand weniger nachprüfbarer Kriterien zu analysieren, legten die Forscher 62 verschiedene Parameter für die automatisierte Auswertung der Aufnahmen fest (Multi-Parameter-Bildanalyse). Diese Kriterien halfen ihnen zu bestimmen, wie sich die Blockade eines Gens auf die Endozytose auswirkt. So konnten sie unter dem Mikroskop beobachten, wie sich die Aufnahme von Stoffen in die Zelle veränderte, wenn eines der rund 24.000 menschlichen Gene nicht aktiv war.
"Wir haben eine komplett neue Strategie entwickelt, die viele Komponenten zu einem großen Analysesystem verbindet: ein RNAi-Screen, automatische, hoch aufgelöste Mikroskopie, eine quantitative Bildanalyse nach mehreren Parametern - und Rechenpower", berichtet Zerial. Am Ende häuften sich zweieinhalb Millionen Bilder an, die ausgewertet werden mussten. Die unglaublichen Datenmengen konnte deshalb nur noch mit Hilfe eines Supercomputers bewältigt werden: Dies wurde in einer Kooperation mit dem Zentrum für Informationsdienste und Hochleistungsrechnen (ZIH) an der TU Dresden möglich. Ein Computer hätte für die Auswertung immerhin über 4 Millionen Stunden benötigt, um schließlich statistisch verlässliche Daten zu bekommen. "Aber die Kraftanstrengung hat nicht nur wichtige neue Erkenntnisse gebracht; sie war auch als Ausgangsbasis dafür nötig, um diese Technologie in Zukunft effizienter und kostengünstiger einsetzen zu können", so Zerial.
Der nächste Schritt wird sein, das erfolgreich durchgeführte Screening-Programm nun an komplexeren Zellen oder mit Hilfe von Modellorganismen, in denen ein bestimmtes Krankheitsbild simuliert wird, zu testen. Dann wird sich sein wahres Potenzial vor allem für die Medikamentenentwicklung zeigen. Ivan Baines, Director of Services and Facilities am Max-Planck-Institut für molekulare Zellbiologie und Genetik, umschreibt die Zukunft des Projekts: "Dann werden wir sehen, ob die Technik dabei hilft, neue Therapieansätze zu finden und genau zwischen heilenden und unerwünschten toxischen Wirkungen möglicher Wirkstoffe unterscheiden zu können."
Originalveröffentlichung: Claudio Collinet, Martin Stöter, Charles R. Bradshaw, Nikolay Samusik, Jochen C. Rink, Denise Kenski, Bianca Habermann, Frank Buchholz, Robert Henschel, Matthias S. Mueller, Wolfgang E. Nagel, Eugenio Fava, Yannis Kalaidzidis & Marino Zerial; "Systems survey of endocytosis by multiparametric image analysis"; Nature 2010.