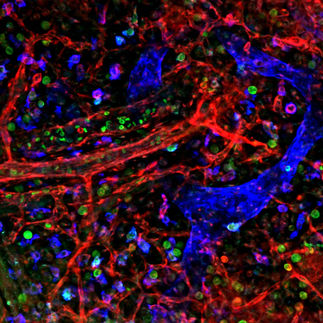
Nanokristalle könnten Krebsmedikamente effizienter machen
Wirkstoffe gegen Krebs haben häufig unerwünschte Nebenwirkungen. Ziel neuartiger Krebstherapien ist daher, den Wirkstoff möglichst effizient in den Tumor einzubringen und dadurch den Körper so wenig wie möglich zu belasten. Wissenschaftler um Dr. Manfred Ogris von der Ludwig-Maximilians-Universität (LMU) München haben nun in einer fächerübergreifenden Studie ein Verfahren entwickelt, mit dem sich die zeitliche Verteilung der Wirkstoffe im Körper sehr genau beobachten lässt. Dabei werden fluoreszierende Nanokristalle an sogenannte Genfähren gekoppelt. Diese werden in den Tumor eingeschleust und erst dort in Proteine umgewandelt, die dann die Krebszellen gezielt angreifen können. Mithilfe von Licht im Nahinfrarot-Bereich konnten Ogris und sein Team nun durch die Fluoreszenz der Nanokristalle verschiedene Arten von Genfähren beobachten und deren Verteilung im Körper im Sekunden- und Minutenbereich verfolgen. Die neue Methode könnte es in Zukunft erleichtern, gezielt wirkende Krebsmedikamente zu entwickeln und weiter zu verbessern.
Bösartige Tumoren besitzen eine besondere Eigenschaft: Sie haben ein System aus Blutgefäßen, das im Gegensatz zu gesundem Gewebe löchrig und damit für größere Teilchen durchlässig ist. Um solche Tumoren effizient zu behandeln, haben Wissenschaftler in den letzten Jahren Trägersysteme entwickelt, mit denen Wirkstoffe in das Tumorgewebe transportiert werden können. Damit ist es möglich, das bösartige Gewebe gezielt anzugreifen und zugleich unerwünschte Nebenwirkungen zu reduzieren. Ein wesentlicher Faktor für die Entwicklung effizienter Transportsysteme ist die zeitliche Verteilung der Wirkstoffe im Körper. Ziel dabei ist, dass diese nicht sofort über die Leber oder die Niere wieder ausgeschieden werden. Stattdessen sollen sie zunächst im Blut zirkulieren und sich dann vor allem im Tumorgewebe anlagern.
Nun hat ein Team aus Pharmazeuten, Biologen und Physikern um Dr. Manfred Ogris vom Department Pharmazie der LMU erstmals eine Methode entwickelt, mit der sich die Verteilung von Wirkstoffen im Körper zeitlich sehr genau beobachten lässt. Dr. Andrey Rogach und sein Team vom Department Physik der LMU und dem Münchner Center for NanoScience (CeNS) entwickelten sogenannte Quantumdots: Winzige Kristalle aus dem Halbleitermaterial Cadmiumtellurid, die gerade einmal zwei bis acht Nanometer groß sind. Diese Kristalle haben die Eigenschaft, bei Bestrahlung mit Licht höherer Energie je nach der Größe in verschiedenen Farben zu fluoreszieren. „Im Gegensatz zu bisher entwickelten Quantumdots sind diese Partikel direkt im Wasser hergestellt und dadurch sehr klein“, erläutert Rogach. „Außerdem leuchten sie nicht nur im sichtbaren, sondern auch im nahinfraroten Spektralbereich – eine Eigenschaften, die speziell für Anwendungen im Gewebe sehr wichtig ist.“
Im nächsten Schritt koppelten die Wissenschaftler im Team von Ogris die Quantumdots an Genfähren, die einen DNA-Abschnitt sowie ein positiv geladenes Makromolekül enthalten. „Mithilfe der DNA-Sequenz werden später im Tumor Proteine hergestellt, die selektiv die Tumorzellen angreifen“, erläutert Ogris. „Das Makromolekül dient dagegen dazu, die negativ geladenen Quantumdots fest an die Genfähre zu koppeln und zu verpacken. Die winzigen Teilchen werden dabei in das Molekül eingelagert wie Rosinen in einen Kuchen.“ Die Wissenschaftler bezeichnen diese Strukturen als „Quantoplexe“. Durch Bestrahlung mit Licht im Nahinfrarot-Bereich - der sogenannten Fluoreszenz-Nahinfrarot-Spektroskopie - kann nun die Verteilung der Partikel im Körper zeitlich exakt verfolgt werden.
Zunächst beobachteten Ogris und sein Team die Verteilung der Quantumdots ohne angehängte Genfähre. Dazu spritzten sie die Partikel Mäusen, die durch ein Betäubungsmittel ruhig gestellt waren, und nahmen alle 15 Sekunden ein Bild des Körpers auf. Dadurch konnten sie eine typische zeitliche Verteilung im Körper beobachten: Unmittelbar nach der Injektion fanden sich die Teilchen vor allem im Blut, in den Lymphgefäßen und in der Leber. Nach wenigen Stunden wurde dann der Großteil wieder über die Leber ausgeschieden. Waren die Partikel dagegen an Genfähren gekoppelt, die eine Größe von 100 bis 300 Nanometer besitzen, zeigte sich ein deutlich anderes Verteilungsbild: Nun lagerte sich ein Großteil der Teilchen in der Lunge, ein kleinerer Teil in der Leber an.
„Diese Verteilung ist natürlich nicht immer gewünscht“, erläutert Ogris. „Daher haben wir in einem weiteren Experiment die Oberfläche der Genfähren mit einem anderen Makromolekül, dem sogenannten Polyethylenglykol oder PEG, abgeschirmt.“ Tatsächlich verhinderte diese Abschirmung eine Wechselwirkung der Teilchen mit dem Blut – mit dem Effekt, dass sich deutlich mehr Moleküle im Tumor beobachten ließen. Und obwohl die Genfähren im Blut schon nach wenigen Minuten in die Leber transportiert wurden, war noch 15 Minuten nach der Injektion ein deutliches Signal im Tumorgewebe zu erkennen - ein Zeichen, dass die in den Tumor gewanderten Partikel dort auch längere Zeit verbleiben.
„In Zukunft könnten fluoreszierende Nanokristalle wesentlich dazu beitragen, Trägersysteme zur Behandlung von Tumoren zu untersuchen und nachhaltig zu verbessern“, sagt Ogris. Dies sei zwar momentan nur im Tiermodell möglich, da das verwendete Cadmiumtellurid langfristig giftig ist und in sehr geringen Mengen im Körper verbleibt. „Wesentlich für die Entwicklung neuer Krebsmedikamente ist jedoch, zunächst ihre Verteilung im Körper und ihre Wirkmechanismen genau zu verstehen“, betont Ogris. So wollen die Forscher als nächstes mithilfe von Quantumdots Genfähren untersuchen, die nur bestimmte, tumorspezifische Rezeptoren erkennen und so den Tumor gezielt angreifen.
Originalveröffentlichung: Arkadi Zintchenko et al.; „Drug Nanocarriers Labeled With Near-infraredemitting Quantum Dots (Quantoplexes): Imaging Fast Dynamics of Distribution in Living Animals”; Molecular Therapy, Online Edition, 25. August 2009
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!