Körperzellen erstmals ohne Gentransfer reprogrammiert
Wissenschaftler aus Kalifornien und Münster etablieren neue Methode zur Erzeugung Protein-induzierter pluripotenter Stammzellen
Anzeigen
Einem internationalen Team von Stammzellforschern ist es erstmals gelungen, Protein-induzierte pluripotente Stammzellen (piPS) ganz ohne gentechnische Modifikationen des Erbguts zu erzeugen. Wie die Wissenschaftler berichten, konnte die Reprogrammierung sehr junger Hautzellen von Mäusen allein durch die Zugabe von Proteinen erreicht werden. Das Team um Hans Schöler vom Max-Planck-Institut für molekulare Biomedizin in Münster konnte die Pluripotenz, also die Alleskönner-Eigenschaft, der am kalifornischen Scripps Research Institute erzeugten Zellen nachweisen. Die neue biochemische Methode zur Reprogrammierung von Körperzellen ist einfacher und sicherer als alle bisher bekannten Methoden.
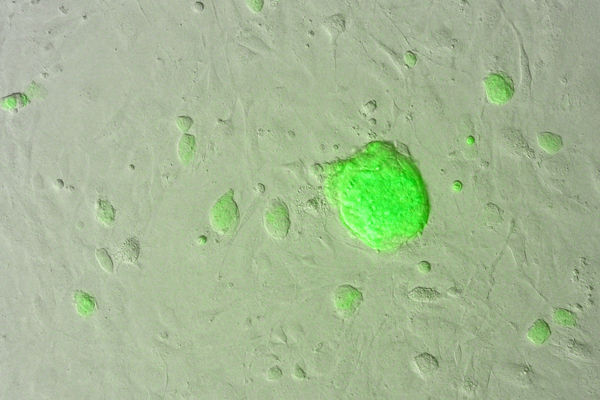
Protein-induzierte pluripotente Stammzellen (piPS), die aus jungen Fibroblasten der Maus gewonnen wurde. Die Markierung erfolgte mit dem grün-fluoreszierenden Markergen Oct4.
Max-Planck-Institut für molekulare Biomedizin / Jin Young Joo
Die vorliegende Entwicklung bietet einen weiteren wichtigen Fortschritt bei der Erzeugung krebsunanfälliger Stammzellkulturen, die in der Medizin der Zukunft eine bedeutende Rolle spielen könnten. "Die Stammzellforschung mit iPS scheint derzeit regelrecht zu explodieren. Wir erleben nahezu monatlich bahnbrechende Neuerungen. Das ist großartig. Die internationale Zusammenarbeit beschleunigt diese Prozesse natürlich zusätzlich", erklärt Hans Schöler, Direktor am Münsteraner Max-Planck-Institut, der mit Sheng Ding vom Scripps Research Institute seit 2004 kooperiert.
Die Macht der Proteine
Den Wissenschaftlern am Scripps Research Institute ist es gelungen, embryonale Maus- Fibroblasten, also Frühstadien von Hautzellen, im Reagenzglas mit einem Protein-Cocktail zu versorgen, der ein Umschalten verschiedener Gene in der Erbinformation der Hautzelle zur Folge hat. Diese Umschaltung bildet die Grundlage für die Reprogrammierung der Hautzellen, die sich dann zu Alleskönner-Zellen zurück verwandeln und wieder über universelle Fähigkeiten verfügen, die als ‚Pluripotenz’ bezeichnet werden. Die Wissenschaftler des Max-Planck-Instituts stellten ihren Kollegen in den USA zunächst die Maus-Fibroblasten zur Verfügung, um später die dort reprogrammierten Zellen auf ihre Alleskönner-Qualitäten zu testen. Die erzeugten Zellen wiesen tatsächlich die typischen Eigenschaften pluripotenter Stammzellen auf. "Die Versuche zeigen eindrucksvoll, dass die Integration von Genen mittels viraler Genfähren bei Mauszellen nicht zwingend notwendig ist. Die Gabe der entsprechenden Proteine in Kombination mit einem ‚small molecule’ ist ausreichend um die Reprogrammierung zu initiieren", erläutert Schöler.
Dieses ‚small molecule’ ist eine kleine chemische Substanz, die das Andocken der Proteine an die DNA erleichtert. Bisher war in den international etablierten Methoden ein Gentransfer der Gene (Oct4, Sox2, Klf4 und cMyc) mit oder ohne Integration in der Zielzelle notwendig. Gene sind die Baupläne für Proteine. Bei den genetischen Eingriffen kann es zu einer Inaktivierung anderer Gene oder sogar zu einer Entartung der Zelle kommen. Die Zugabe von Proteinen dagegen stellt nach heutigen Kenntnissen kein Risiko für das Erbgut dar. Um die Proteine in die Mauszellen zu schleusen, nutzen die US-amerikanischen Forscher ein kurzes Verbindungsprotein (Peptid), das an die Proteine gebunden wird und den Transfer durch die Zellmembranen ermöglicht. Die Proteine haben im Plasma der Zelle eine nur kurze Überlebenszeit. Deshalb muss die Behandlung mit dem Protein-Cocktail über mehrere Tage wiederholt vorgenommen werden. Erst dann entstehen die gewünschten Stammzellkolonien.
Nach der Maus kommt der Mensch
Induzierte pluripotente Stammzellen (iPS und piPS) können sich zu jedem denkbaren Zelltyp, wie etwa einer Nervenzelle oder einer Leberzelle, entwickeln. Solche Zellen könnten in zukünftigen Therapien von Krankheiten wie Parkinson und Diabetes oder auch bei der Regeneration von Nervenverbindungen, zum Beispiel bei Menschen mit einer Querschnittslähmung, eine entscheidende Rolle spielen. Solche Zellersatztherapien bilden aber nur einen Bereich des Potentials von Stammzellen. Einen weiteren bedeutenden Einsatzbereich sieht die Wissenschaft in der Analyse von Krankheitsentwicklungen und der Optimierung personenspezifischer Medikation. "Die heute vorgelegten Ergebnisse stammen aus Tests an Mauszellen. Der nächste Schritt ist natürlich die Übertragung auf menschliche Zellen. Das ist etwas, was uns in Münster ab sofort beschäftigen wird", kommentiert Schöler, der sich bereits auf die für Anfang 2010 geplante Erweiterung der Stammzellforschung durch zusätzliche Fördermittel des Landes Nordrhein-Westfalen und der Max-Planck-Gesellschaft freut.
Originalveröffentlichung: Hongyan Zhou et al.; "Generation of Induced Pluripotent Stem Cells Using Recombinant Proteins"; Cell Stem Cell, Online-Vorabveröffentlichung, 23. April 2009