Forscher ermöglichen Vorhersage neuer therapeutischer Ziele von Medikamenten
Ein von Dr. Carlo Vittorio Cannistraci, Nachwuchsgruppenleiter der Biomedizinischen Kybernetik am BIOTEChnologischen Zentrum der TU Dresden, geleitetes internationales Team von Wissenschaftlern hat eine leistungsfähige Berechnungsmethode entwickelt, welche Prinzipien der Selbstorganisation eines Gehirnnetzwerkes nutzt, um neue höchst zuverlässige Arzneimittel-Ziel-Interaktionen vorherzusagen. Für diese Vorhersage ist nur die Kenntnis der Verknüpfungsstruktur des molekularen Netzwerkes, nicht aber die Kenntnis der chemischen Strukturen der Arzneimittel notwendig.
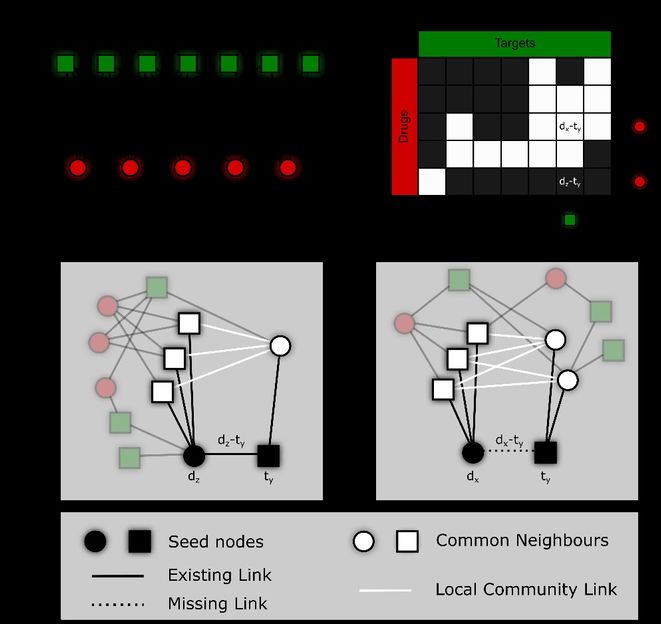
Begriffliche Repräsentation der Vorhersage neuartiger Wirkstoffziel-Interaktionen in molekularen Netzwerken
© Cannistraci lab
<<The brain is just the weight of God, […] >> mit diesen Worten beschrieb Emily Dickinson die Großartigkeit des Gehirns. Jedoch wäre es selbst für einen kreativen Poeten schwierig vorherzusagen, ob die selben Organisationsregeln den allgemeinen Prinzipien der Organisation komplexer Systeme soweit ähneln, ebenfalls Gehirnnetzwerke exakt genug beschreiben, so dass diese zur Vorhersage von Interaktionen zwischen bekannten Medikamenten und neuen therapeutischen Zielen in molekularen Netzwerken herangezogen werden können.
Die Arzneimittelentwicklung steht immer höheren Kosten gegenüber. Neueste Schätzungen gehen von über einer Milliarde US-Dollar für jede neue Markteinführung aus. Die Neupositionierung von Arzneimitteln durch die Identifizierung neuer Nutzungsmöglichkeiten für Arzneimittel scheint eine vielversprechende Lösung für dieses wirtschaftliche Problem zu sein. Eine Voraussetzung für eine solche Neupositionierung ist die Identifizierung neuer Ziele für bekannte Arzneimittel. Aus diesem Grund wurde eine große Anzahl an Methoden und Datensätzen vorgeschlagen und bei dieser Arzneimittel-Target Interaktion (DTI) angewendet.
Es sind vor allem zwei Aspekte, welche die von Dr. Cannistraci und seinen Kollegen vorgeschlagene Methode besonders machen. Zum einen nutzt diese Methode eine von Gehirn-Netzwerken abgeleitete Regel zur Bildung neuer Verbindungen. Zum anderen können mithilfe dieser Methode neue Arzneimittel-Target Interaktionen vorhergesagt werden. Dies geschieht durch die ausschließliche Nutzung eines bekannten Netzwerkes aus bereits etablierten Interaktionen. Zusätzliche biologische oder molekulare Informationen wie z.B. die chemischen Gemeinsamkeiten für Arzneimittel, sowie Ähnlichkeiten in der Proteinsequenz von Zielmolekülen, sind dabei nicht notwendig. Die Fähigkeit zur Vorhersage neuer Interaktionen ergibt sich aus der nichtlinearen strukturellen Organisation eines komplexen Netzwerkes. Auf Basis dieser Beobachtung entwickelte Dr. Cannistraci vor einigen Jahren die Local-Community-Paradigm (LCP) – Theorie, welche besagt, dass viele reale komplexe Netzwerke in ihrer strukturellen Organisation aus lokalen Gemeinschaften Gehirnnetzwerken ähneln. Diese lokalen Gemeinschaften begünstigen eine hohe Signalaktivität und damit die Entwicklung neuer Verbindungen in den Gemeinschaften.
Die Idee von Dr. Cannistraci wurde durch die bekannten Hebb’schen Lernregeln inspiriert. Diese Regeln wurden Ende der 40’er Jahre durch den Psychologen Donald Olding Hebb aufgestellt. Je häufiger verschiedene Neurone gleichzeitig aktiv sind, umso bevorzugter werden Verbindungen zwischen ihnen entstehen. Dr. Cannistraci nahm wahr, dass die Netzwerktypologie eine entscheidende Rolle bei der Isolierung von Neuronenkohorten in funktionalen Modulen spielt. Diese können auf eine natürliche Art und Weise, sowie bevorzugt eine lokale Verarbeitung durchführen – denn die Lokale-Gemeinschafts-Organisation der Netzwerktypologie erstellt eine physikalische und strukturelle ‚Energie-Schranke‘ (eine topologische Lücke zwischen verschiedenen Gemeinschaften). Diese beschränkt die Neuronen darin, gemeinsam in einer bestimmten Gemeinschaft zu feuern und daraus resultierend neue Links inmitten dieser Gemeinschaft zu schaffen. Aus dieser lokalen Netzwerkkonnektivität ergibt sich ein Lernprozess, den Cannistraci als epitopologisches Lernen bezeichnet. Dieses entsteht als eine allgemeine topologische Interpretation des Hebb’schen Lernens – dessen Definition nur für neuronale Netzwerke gegeben war. Deshalb wurden sowohl das epitopologische Lernen als auch das damit in Verbindung stehende Lokale-Gemeinschaft-Paradigma (LCP) entsprechend als lokale Lern- und Organisationsregeln vorgeschlagen, die sowohl allgemein für die Modellierung von Verbindungswachstum als auch für die Vorhersage topologischer Verbindungen in jedem komplexen Netzwerk mit einer LCP Architektur gelten. Die Studie wurde im Wissenschaftsjournal „Briefing in Bioinformatics“ vorgestellt. In der Vorstellung wird deutlich, dass die LCP-Theorie und der abgeleitete Algorithmus für eine Verbindungsvorhersage auf Basis des epitopologischen Lernens, hervorragende Ergebnisse auch in der Vorhersage netzwerkbasierter Arzneimittel-Ziel-Interaktionen liefern.
“Ich war begeistert, als ich die ersten Ergebnisse der Studie sah. Sie zeigten, dass eine einfache und aus dem Gehirnnetzwerk abgeleitete, unbeaufsichtigte Organisationsregel viel schneller arbeiten kann und trotzdem eine Vorhersageleistung hat, die mit komplizierten und beaufsichtigten Algorithmen aus wissensbasiertem Engineering vergleichbar ist. Zukünftig möchte ich mich gern auf die Entwicklung neuer hybrider und adaptiver Algorithmen, welche die Vorteile beider Vorhersagestrategien beinhalten, fokussieren ” erklärt Claudio Durán, einer der Erstautoren dieser Studie.
„Gehirnnetzwerke und die Regeln hinter ihrer Selbstorganisation faszinieren mich bereits seit meiner Schulzeit. Ich entschied mich, mein Leben dem Studium der Organisation von Gehirnnetzwerken zu widmen. Dabei wollte ich herausfinden, wie es dazu beiträgt, die Welt um uns herum zu repräsentieren und vorherzusagen. In unserer Studie zeigen wir, dass einige bei der Organisation von Gehirnnetzwerken beteiligten einfachen Regeln (zur Realisierung der Lernfähigkeit) tatsächlich allgemeine Regeln der Selbstorganisierung komplexer Netzwerke sind. Gleichermaßen können sie eingesetzt werden, um die Interaktionen molekularer Netzwerke ohne ein vorhandenes Wissen zu den molekularen Eigenschaften – und nur durch die Untersuchung der Netzwerkorganisation – vorherzusagen. Die Schlussfolgerung lautet, dass viele Systeme sehr schnell lernen können, indem sie ihre Struktur modifizieren. Denn ihre Verbindungen sind bereits so organisiert, dass sie vorschlagen können, wo genau solch strukturelle Modifikationen entstehen sollten. Dieses Prinzip kann zum Entwurf neuer effizienter Algorithmen zur Verbindungshersage genutzt werden – und dies im Allgemeinen in vielen Netzwerktypen” sagt Carlo Vittorio Cannistraci, der erste korrespondierende Autor dieser Studie.
Originalveröffentlichung
“Pioneering topological methods for network-based drug-target prediction by exploiting a brain-network self-organization theory”; Claudio Durán* Simone Daminelli*, Josephine M. Thomas*, V. Joachim Haupt, Michael Schroeder & Carlo Vittorio Cannistraci (*gleichermaßen beigetragen); Briefings in Bioinformatics; bbx041 (2017)