Tödliches Nanopaket für Krebszellen
Hybrides Nanomaterial zerstört hypoxische Krebszellen durch gezielte Freisetzung von reaktiven Radikalen
Anzeigen
Krebstherapien mit reaktiven Sauerstoffspezies sind in den Regionen von Tumoren mit geringer Sauerstoffkonzentration häufig unwirksam. Amerikanische Wissenschaftler haben jetzt ein hybrides Nanomaterial entwickelt, das durch Hitzeaktivierung in Tumorzellen eine Vorstufe für freie Radikale freisetzt. Wie sie in der Zeitschrift Angewandte Chemie berichten, zerstören die freien Radikale die Zellkomponenten auch unter Sauerstoffmangel und induzieren dadurch den Zelltod (Apoptose). Die Freisetzung der Substanz am Zielort und ihre Wirkung können präzise gesteuert werden.
© Wiley-VCH
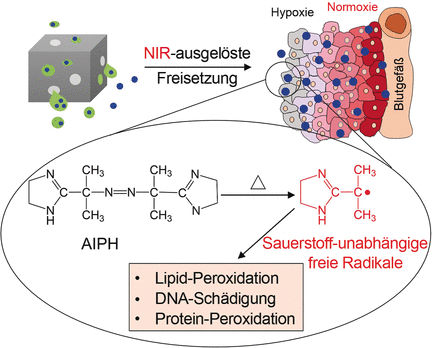
Viele etablierte Behandlungsmethoden von Krebs basieren auf der Erzeugung von reaktiven Sauerstoffspezies (ROS), die bei den Tumorzellen den Zelltod einleitet. Allerdings muss dafür Sauerstoff vorhanden sein, und hypoxische (Sauerstoffmangel-) Regionen im Tumorgewebe überleben häufig ROS-Behandlungen. Younan Xia am Georgia Institute of Technology und der Emory University in Atlanta (USA) und sein Team haben daher eine Strategie entwickelt, um eine Substanz, die nach gezielter Aktivierung in Radikale zerfällt, in Zellen einzuschleusen, wo sie diese nach einem ROS-ähnlichen Mechanismus auch unter hypoxischen Bedingungen zerstören kann.
Wie die Autoren erläutern, wurden sie auf der Suche nach einer Verbindung, die genügend Radikale produziert, im Bereich der Polymerchemie fündig. Dort ist die Azo-Verbindung AIPH ein bekannter Polymerisationsstarter, der Alkylradikale freisetzt. In medizinischen Anwendungen führte AIPH zu DNA-Schädigungen und zu Lipid- und Protein-Peroxidationen, auch wenn kaum freier Sauerstoff zur Verfügung stand. Zunächst muss dafür aber das empfindliche AIPH in die Zellen im Gewebe hineingebracht werden. Die Wissenschaftler verwendeten daher Nanokäfige, deren Hohlräume sie mit Laurinsäure füllten. Dieses so genannte „Phase-Change-Material“ (PCM) kann als Trägermaterial für AIPH dienen. Befindet sich der Nanokäfig im Zielgewebe, heizt eine Bestrahlung mit einem Nahinfrarot-Laser diese Nanokäfige auf, sodass das PCM schmilzt und seine AIPH-Fracht freisetzt. Das AIPH zerfällt sofort in freie, hochreaktive Radikale.
Dass dieses Konzept funktioniert, bewies das Team mit einer Reihe von Experimenten an unterschiedlichen Zellsorten. An roten Blutkörperchen wurde erhebliche Hämolyse beobachtet. Lungen-Krebszellen nahmen die Nanoteilchen auf und erlitten durch die Freisetzung des Radikalstarters schweren Schaden. Aktinfilamente zogen sich zusammen und aggregierten. Und die Lungen-Krebszellen wurden, unabhängig von der Sauerstoffkonzentration, erheblich in ihrem Wachstum eingeschränkt.
Obwohl die Autoren zugeben, dass „die Wirksamkeit durch Optimierung der Komponenten und der Bedingungen noch verbessert werden muss“, zeigten sie deutlich, wie ihr Hybridsystem Zellen unabhängig vom Sauerstoffgehalt effektiv abtötete. Diese Strategie könnte für die Nanomedizin, die Krebs-Theranostik und alle Anwendungen interessant sein, bei denen es auf die gezielte Freisetzung einer Substanz mit überragender räumlicher und zeitlicher Auflösung ankommt.























































