Sterben Krebszellen bei Glutamin-Entzug?
Viele Tumoren sind geradezu abhängig von der Aminosäure Glutamin: Nimmt man ihnen den Stoff weg, sterben sie ab. Das klingt nach einem guten Therapieansatz. Doch eine neue Studie bringt diese Idee ins Wanken.

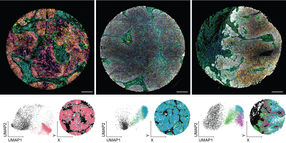
Kulturen von Darmkrebszellen, die zwei Tage lang ohne Glutamin gehalten wurden: Bei hohen exogenen MYC-Konzentrationen (Mitte) sterben die Zellen ab. Links eine Kontrollkultur. Rechts: „Echte“ Tumorzellen überleben, weil sie ihre MYC-Spiegel regulieren können.
Francesca Dejure
Die meisten Krebsarten brauchen für ihr schnelles Wachstum große Mengen Glutamin. Viele wissenschaftliche Studien kommen sogar zu dem Schluss, dass Tumoren ohne Glutamin nicht überlebensfähig sind. Für dieses Phänomen hat sich der Begriff “Glutaminsucht” eingebürgert.
Ein Weg zur Behandlung von Krebs könnte also darin bestehen, dass man den Tumor von der Glutaminzufuhr abschneidet. Forschungsteams aus Würzburg und Berlin kommen nun aber zu dem Schluss, dass ein Glutaminentzug die Tumorzellen zwar bremst, sie aber nicht abtötet. Für eine Therapie würde das ein hohes Rückfallrisiko bedeuten.
Die Studie ist im EMBO Journal veröffentlicht. Erarbeitet wurde sie von den Gruppen um Professor Martin Eilers vom Biozentrum der Universität Würzburg und Dr. Stefan Kempa vom Max-Delbrück-Zentrum für Molekulare Medizin in Berlin.
Es kommt auf die Art der Zellkultur an
Die “Glutaminsucht” von Krebszellen wurde bislang vorwiegend in genetisch manipulierten Zellkulturen untersucht, die zuviel c-MYC produzieren. Dieses Protein ist ein zentraler Regulator des Zellwachstums und der Zellteilung; in Krebszellen ist es oft außer Kontrolle geraten. In diesen Zellkulturen wirkt der Entzug von Glutamin tödlich auf die Tumorzellen.
Aber klappt das auch bei natürlichen Tumorzellen? Um das zu klären, verwendeten die Forscher eine Linie von Darmkrebszellen, in denen c-MYC von Natur aus in zu großen Mengen vorliegt. Sie stellten fest, dass diese Krebszellen nicht absterben, wenn man ihnen Glutamin entzieht. Stattdessen legen sie eine Art Teilungspause ein, aus der sie wieder in den Wachstumszustand zurückkehren können.
Die Forschungsteams stellten außerdem fest, dass sich die beiden Krebszelltypen in der Art unterscheiden, wie sie ihre c-MYC-Produktion regulieren. „Im genetisch veränderten Zellkultursystem bleibt c-MYC immer auf einem hohen Level, während es bei den natürlichen Darmkrebszellen herunterreguliert wird, sobald Glutamin knapp wird“, erklärt Professor Eilers. Das könne bedeuten, dass c-MYC beim Abtöten der Zellen eine Rolle spielt.
Was zu viel c-MYC in Krebszellen bewirkt
Darum gingen die Forscher als nächstes der Frage nach, welche Rolle c-MYC genau spielt und wie es durch Glutamin reguliert wird. Glutamin wird in Zellen an vielen Stellen benötigt, unter anderem zur Produktion von Nukleotiden, den Bausteinen von DNA und RNA. Ist zu wenig Glutamin vorhanden, sinkt die Menge an Nukleotiden. Das wiederum bewirkt, dass auch der c-MYC-Spiegel fällt.
Eine Schlüsselfunktion von c-MYC besteht darin, die Aktivität vieler Gene zu steuern. Wenn also die Nukleotidspiegel und damit die c-MYC-Spiegel fallen, wird auch die Genaktivität gedrosselt. „Unsere Ergebnisse legen nahe, dass c-MYC die Verfügbarkeit von Nukleotiden mit der Transkription koppelt”, sagt Dr. Kempa. “Das ist äußerst sinnvoll. Die Zelle versucht gar nicht erst, RNA zu produzieren, wenn die Grundbausteine dafür fehlen.”
Warum zu viel c-MYC tödlich sein kann
Diese Kopplung funktioniert aber nicht in Zellen, denen die erhöhte c-MYC-Konzentration durch genetische Veränderungen von außen aufgezwungen wurde – und die eingesetzt werden, um die Glutaminsucht von Krebszellen zu erforschen. In ihnen läuft die Transkriptionsmaschinerie auch bei Glutaminentzug einfach weiter, auch wenn zu wenige Nukleotide vorhanden sind. Das kann zu Fehlern führen, die für die Zelle letzten Endes tödlich sind.
„Die Glutaminsucht von Krebszellen wurde vorwiegend in solchen Zellkultursystemen analysiert. Darum hat man das therapeutische Potenzial des Glutaminentzugs bisher vermutlich falsch bewertet”, sagt Professor Eilers.
Originalveröffentlichung
“The MYC mRNA 3′‐UTR couples RNA polymerase II function to glutamine and ribonucleotide levels”; Francesca R. Dejure, Nadine Royla, Steffi Herold, Jacqueline Kalb, Susanne Walz, Carsten P. Ade, Guido Mastrobuoni, Jens Vanselow, Andreas Schlosser, Elmar Wolf, Stefan Kempa and Martin Eilers; EMBO Journal; 13. April 2017