Wie man eine Proteinfalle schmiedet
Neuer Prozess bringt schneller mehr Naturstoff
Wer wirksame Moleküle im Labor nachbauen kann, öffnet die Apotheke der Natur für Medikamente der Zukunft. Mit der Prüfung neu entwickelter Synthese-Prozesse und Katalysatoren ist es in einem Projekt des Wissenschaftsfonds FWF gelungen, den vielversprechenden Naturstoff Brefeldin A schneller und in größerer Menge zu erzeugen.

Brefeldin A ist ein vielversprechender Naturstoff, der unter anderem in der Krebstherapie zum Einsatz kommen könnte. Im Labor wird er nun Schritt für Schritt nachgebaut.
PublicDomainPictures, pixabay.com, CC0
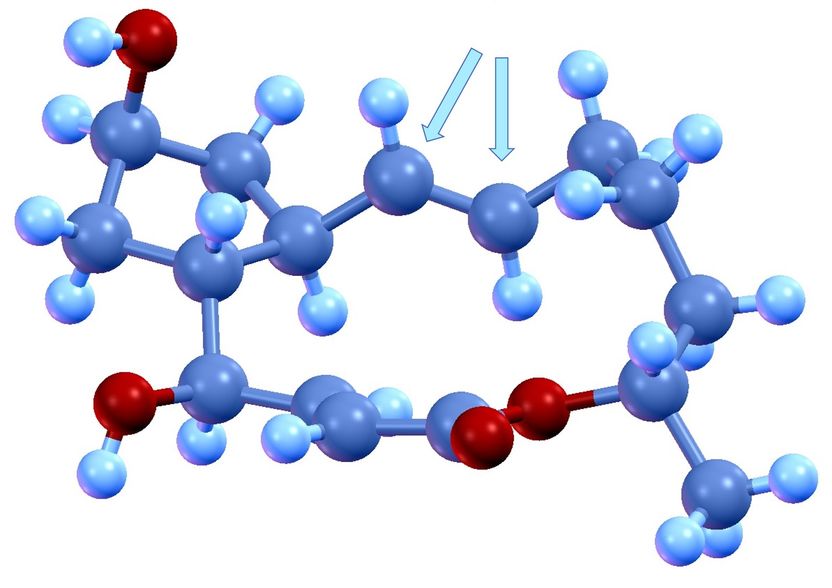
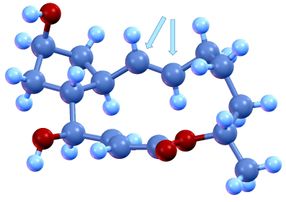
Der makrozyklische Naturstoff Brefeldin A und die kritische trans-konfigurierte Doppelbindung (Pfeile), die über die Wirkung des Moleküls mitentscheidet. Blau = Kohlenstoff; Rot = Sauerstoff; Hellblau = Wasserstoff
Michael Fuchs

Penicillin wurde noch durch Zufall entdeckt. Viele kennen die Geschichte des urlaubenden Alexander Fleming, der nach seiner Rückkehr in das Londoner Labor verschimmelte Nährböden vorfand und Bakterienkulturen, die nicht gediehen. Weitere Versuche offenbarten die tödliche Wirkung des Schimmels auf grampositive Bakterien bei guter Verträglichkeit für den Menschen. Erst Jahre später wurde Penicillin von Kollegen als lebensrettendes Antibiotikum eingesetzt. Heute wird die Apotheke der Natur sehr systematisch durchforstet und die Wirkung von Naturstoffen getestet. Dafür braucht es deutlich mehr als einen Tropfen Pflanzensaft oder Pilzsekret. Michael Fuchs, Universitätsassistent an der Universität Graz, forschte mit einem Erwin-Schrödinger-Stipendium des Wissenschaftsfonds FWF 18 Monate lang am deutschen Max-Planck-Institut für Kohlenforschung.
Die Proteinfalle aus dem Pilz
Auch Brefeldin A stammt aus einem unscheinbaren Schimmelpilz (Penicillium brefeldianum). Der Naturstoff stoppt die Protein-Transportketten in eukaryotischen Zellen. In weiterer Folge zerfällt die zelluläre Proteinfabrik (Golgi-Apparat) und die Zelle stirbt. „Es konnte gezeigt werden, dass Brefeldin A das unkontrollierte Wachstum einer Vielzahl von menschlichen Krebszell-Linien hemmt. Der erste Versuch, den Wirkstoff in die klinische Anwendung zu bringen, schlug jedoch fehl, weil das Molekül sehr schnell abgebaut und ausgeschieden wird“, erklärt Michael Fuchs die Ausgangslage. Der potente Naturstoff kann durch Fermentation des Pilzes gewonnen oder im Labor Schritt für Schritt nachgebaut werden. Bisher beschrittene Synthesewege brachten jedoch nie mehr als 15 Milligramm Ausbeute hervor.
Neuer Prozess bringt schneller mehr Naturstoff
Der Fokus dieses Grundlagenforschungsprojekts lag daher auf einer schnellen Synthese größerer Mengen und der experimentellen Prüfung neu entwickelter Synthese-Methoden und Katalysatoren anhand des komplexen Moleküls. Ein „Knackpunkt“ war der gezielte Nachbau einer trans-konfigurierten Doppelbindung. Für die Wirkung eines Moleküls kommt es nämlich auf die genaue Ausrichtung der chemischen Gruppen im Raum an. Man unterscheidet eine „cis“ und eine „trans“-Form von Molekülen. Im besten Fall ist eine Form unwirksam, im schlimmsten Fall schädlich.
Beim Nachbau im Labor wurden in 16 Reaktionsschritten neue Bestandteile an das wachsende Molekül chemisch angefügt. Die Reaktionen werden mit Katalysatoren gestartet und mit Substraten befeuert. „Im vorletzten Schritt konnten wir ein unvorhergesehenes Nebenprodukt nachweisen, das die Ausbeute des Endproduktes schmälert“, beschreibt Michael Fuchs. Dennoch erbrachte die neue Methode circa 500 Milligramm Brefeldin A, also das 30-fache der bisherigen Menge.
Der Chemiker konnte durch weitere Experimente den Prozessablauf an der gewünschten Stelle anhalten und das Zwischenprodukt genauer untersuchen. Nun kann der Katalysator weiter verbessert werden, um die Reaktion vollständig ablaufen zu lassen. Wer die Bauanleitung genau kennt, kann im nächsten Schritt Derivate mit kleinen chemischen Modifikationen bauen. Naturstoffderivate sind ein etablierter Weg, um Mankos – wie etwa die (zu) rasche Abbaubarkeit – zu beheben. Aktuell arbeitet Michael Fuchs in Graz mit ökologisch unbedenklichen, biokatalytischen Verfahren am Aufbau von Naturstoffen.
Originalveröffentlichung
Fuchs, M.; Fürstner, A.; "trans-Hydrogenation: Application to a Concise and Scalable Synthesis of Brefeldin A"; Angewandte Chemie, Int. Ed. 2015; 54, 3978-3982
Leutzsch, M.; Wolf, L. M.; Gupta, P.; Fuchs, M.; Thiel, W.; Farès, C.; Fürstner, A.; "Formation of Ruthenium Carbenes by gem-Hydrogen Transfer to Internal Alkynes: Implications for Alkyne trans-Hydrogenation"; Angewandte Chemie, Int. Ed.; 2015, 54, 12431-12436