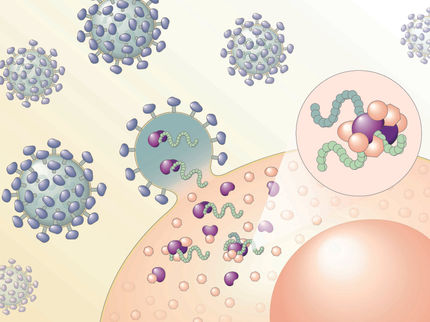
Schlafende AIDS-Viren wecken
Wissenschaftler nehmen „versteckte“ Erreger ins Visier
Anzeigen
Das AIDS-Virus macht es der medizinischen Forschung nicht leicht. Zwar kann man die Virusvermehrung mit antiviralen Medikamenten wirksam verhindern, für eine Heilung müssen jedoch auch die latenten HIV-Reservoire in den Zellen aufgespürt und eliminiert werden. Ulmer Forscher wollen ein neues Verfahren entwickeln, um „schlafende“ HI-Viren gezielt zu aktivieren und sie dadurch empfänglich für die Immunantwort und antivirale Wirkstoffe zu machen. Die VolkswagenStiftung unterstützt dieses ungewöhnliche Projekt im Rahmen der Förderinitiative „Experiment!“ mit 100.000 Euro.
Die elektronenmikroskopische Aufnahme zeigt HIV-Partikel, die an der Oberfläche einer Zelle haften. Zur besseren Darstellung wurden unterschiedliche Grauwerte in Gelb- und Rottöne umgewandelt.
Aufnahme: Dr. Silvia Kluge, Prof. Paul Walther - Uni Ulm
Das Schaubild zeigt die Aktivierung von latentem HIV
Abbildung: Kirchhoff / Barth Uni Ulm
„Eine HIV-Infektion kann mittlerweile mit einer antiviralen Therapie gut behandelt werden. Doch die Viren können in latenter Form lebenslang im Körper überdauern und die Krankheit immer wieder zum Ausbruch bringen“, erklärt Professor Frank Kirchhoff die Ausgangslage. Der Leiter des Instituts für Molekulare Virologie an der Universität Ulm will gemeinsam mit seinem Ulmer Kollegen, Professor Holger Barth vom Institut für Pharmakologie und Toxikologie, einen neuartigen Ansatz entwickeln, um die „schlafenden“ Viren in ihren zellulären Verstecken aus der Deckung zu holen und diese danach immunologisch und pharmakologisch attackieren zu können.
Die Idee: Das Virus wird durch einen speziellen Aktivator dazu gebracht, sich in allen befallenen Zellen zu vermehren, auch in den latenten HIV-Reservoiren. Ein biomolekulares Shuttle-System sorgt dafür, dass der Aktivator in den Zellkern gelangt, wo sich die „stummen“ HI-Viren im Chromosom der Wirtszelle verstecken. Die Ulmer Wissenschaftler setzen dabei auf einen der wirkungsvollsten HIV-Aktivatoren, der bislang bekannt ist: das virale Transaktivator-Protein Tat, das den viralen Vermehrungszyklus in Gang setzt. „Damit lassen sich möglicherweise HI-Viren in allen infizierten Zellen aktivieren“, erläutert der Virologe Kirchhoff. Angegriffen werden von den AIDS-auslösenden Viren insbesondere bestimmte Zellen des Immunsystems wie Helfer-T-Zellen, deren Verlust letztendlich zur Immunschwäche-Erkrankung führt.
Um das Tat-Protein an seinen Zielort – den Zellkern – zu bringen, greifen die Forscher auf eines der effektivsten molekularen Transportsysteme zurück, das die Natur zu bieten hat: bakterielle Protein-Toxine. „Wir haben diese bakteriellen Bestandteile, die normalerweise extrem toxisch wirken, gentechnologisch so verändert, dass sie dem Wirtsorganismus keinen Schaden mehr zufügen können“, versichert der Toxikologe Barth, der an der Uni die Wirkungsweise bakterieller Toxine erforscht und diese als hoch-effiziente Nanomaschinen für den Wirkstofftransport in Zellen entwickelt. Als Bio-Shuttle kommen bakterielle Bestandteile von Clostridium botulinum (C2) als auch von Diphteria (DT) zum Einsatz, mit deren Hilfe das Tat-Protein in das Innere der Zelle gelangen und die Membran des Zellkerns durchdringen soll. Auch die Blut-Hirn-Schranke soll mit Hilfe derartiger Molekulartransporter überwunden werden, um HI-Viren im Gehirn aktivieren zu können.
Doch dabei wollen es die Wissenschaftler nicht belassen: „Es reicht natürlich nicht und ist sogar gefährlich, lediglich die HIV-Replikation auszulösen“, meint Professor Frank Kirchhoff. „Gleichzeitig müssen mittels antiviraler Wirkstoffe neue Infektionen verhindert und durch immunologische Ansätze die Viruspartikel und infizierte Zellen zerstört werden“, so der Virologe weiter. Und wieder behelfen sich die Wissenschaftler dabei mit einem biomolekularen Trick. Als Transporter setzen sie Streptiavidin ein, ein äußerst Biotin-affines bakterielles Protein. „Dieses koppeln wir sozusagen als Anhänger an unser Bioshuttle, um die antiviralen Substanzen damit direkt an ihren Wirkort zu bringen“, verdeutlicht Professor Holger Barth.
Die beiden Projektpartner sind sich durchaus bewusst, dass der Ansatz ungewöhnlich und nicht ohne Risiko ist. „Schließlich benutzen wir nicht nur einen Faktor, der die Virusmehrung zunächst drastisch steigert, sondern koppeln ihn auch noch mit Bestandteilen von ursprünglich hoch-toxischen bakteriellen Toxinen als Wirkstofftransporter. Das hört sich sicherlich zunächst etwas seltsam an“, meinen die Forscher.