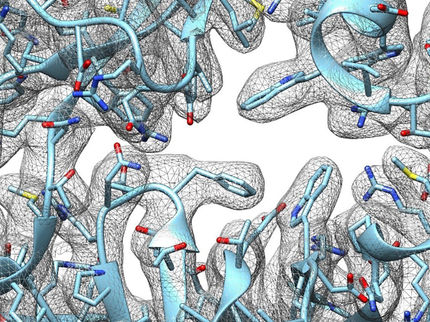
Neue Mikroskopie-Technik bringt Feinstrukturen des Lebens ans Licht
Forscher erstellen Modell eines Protein-Filaments in atomarem Detail
Eigentlich liebt Ignicoccus hospitalis es warm. Zu den Archaeen gehörend, einer urtümlichen einzelligen Lebensform neben Bakterien und Lebewesen mit Zellkern, fühlt es sich am wohlsten in heißen unterseeischen Vulkanquellen vor Island, bei Temperaturen knapp unter 100 Grad. Im Namen der Forschung wurde es jetzt eisig für den Einzeller: Ein internationales Forscherteam unter Führung Jülicher Wissenschaftler nutzte das extrem hochauflösende, mit schockgefrorenen Proben arbeitende Verfahren der Cryo-Elektronenmikroskopie, um ein Modell der Filamente des Bakteriums in atomarem Detail zu erstellen. Diese langgestreckten Proteinfasern sind unter anderem deshalb von Interesse, weil sie starke Ähnlichkeit zu sogenannten Flagellen aufweisen, mit deren Hilfe sich viele Prokaryonten - Lebensformen ohne Zellkern - fortbewegen. Das detaillierte 3D-Modell der Struktur könnte so zu einem besseren Verständnis dieser biologischen Antriebssysteme beitragen.

Computerprogramme können tausende Einzelbilder aus verschiedenen Blickwinkeln analysieren, um hochaufgelöste 3D-Modelle zu errechnen, wie hier im Bild erkennbar.
Copyright: Forschungszentrum Jülich

Cryo-elektronenmikroskopische Aufnahme eines Filamentes aus tausenden Einzelmolekülen sogenannter Flagellin-Proteine.
Copyright: University of Virgina/ FEI
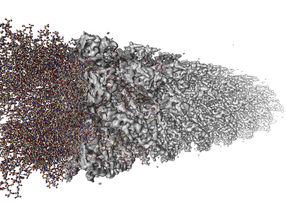

In der Welt der Archaeen und Bakterien ist die Flagelle das Fortbewegungsmittel der Wahl. Die langgestreckten Fäden oder "Filamente" aus Proteinen werden dabei von einer Art molekularem Motor in der Zellwand bewegt und erzeugen so Schub. In der Biologie wurden die Flagellensysteme der Bakterien bereits umfassend erforscht, während über deren Struktur in den Archaeen wenig bekannt ist.
Das erste atomare Modell eines flagellenähnlichen Filaments eines Archaeums wurde nun von Jun.-Prof. Gunnar Schröder und seiner Doktorandin Tatjana Braun auf der Basis von Aufnahmen erstellt, die Kooperationspartner der University of Virginia mithilfe eines extrem hochauflösenden Cryo-Elektronenmikroskops von Ignicoccus-Proben aufgenommen hatten. Diese stammten aus dem Archaeen-Zentrum der Universität Regensburg.
Es war bereits bekannt, dass die Gene für die Ausbildung der Flagellen von Archaeen und Bakterien grundsätzlich verschieden sind. Die nun gewonnenen Daten zeigen, dass sich archaeelle und bakterielle Flagellen auch in ihrer Struktur grundsätzlich unterscheiden. Sie sind also von der Natur zweimal erfunden worden und somit ein Beispiel konvergenter Evolution.
Schröder und Braun arbeiten in der Forschungsgruppe Computergestützte Strukturbiologie am Jülicher Institute of Complex Systems (Strukturbiochemie, ICS-6) an Auswertungs- und Modellierungssoftware für die derzeit rasch wachsende Cryo-EM-Forschergemeinde. Das Computerverfahren, mit dem die elektronenmikroskopischen Bilder zu einer dreidimensionalen atomaren Struktur umgesetzt wurden, entwickelte Braun im Rahmen ihrer Promotion.
Erst in jüngster Zeit haben Cryo-Elektronenmikroskope Auflösungen erreicht, die ausreichen, biologische Strukturen wie diejenigen von Proteinmolekülen atomar analysieren zu können.
Für die Strukturbiologie eröffnet das viele neue Möglichkeiten. Denn die bisher gängigen Verfahren der Röntgenkristallographie und NMR-Spektroskopie können Proteinstrukturen zwar in ähnlichen Auflösungen liefern, haben allerdings Limitierungen, wenn es um größere Strukturen aus hunderten oder tausenden Proteinen geht. Mit der Cryo-EM als neuer Methode wird es nun wesentlich einfacher zu verstehen, wie sich einzelne Proteinmoleküle zu Makrostrukturen zusammenfügen, die als molekularen Maschinen im Körper funktionieren. Jede der drei Methoden hat dabei eigene Stärken und Schwächen, sodass gerade in ihrer Kombination die größten Chancen für die Zukunft liegen, erklärte Schröder kürzlich gegenüber dem Fachmagazin Nature. In seiner Jülicher Forschungsgruppe entwickelt er deshalb auch spezielle Software-Systeme für Zusammenführung der unterschiedlichen experimentellen Daten.
"Die neue Generation der Cryo-EM-Geräte hat ihr enormes Potenzial bereits jetzt ganz unzweifelhaft unter Beweis gestellt", sagt Prof. Dieter Willbold, Direktor des Jülicher ICS-6. "Auf lange Sicht werden sie unverzichtbar werden für anspruchsvolle strukturbiologische Fragen. Wir wollen in Jülich deshalb heute schon die nötige Expertise aufbauen und hoffen, in naher Zukunft auch eigene Geräte anschaffen zu können."
Originalveröffentlichung
Braun T, Vos M, Kalisman N, Rachel R, Wirth R, Schröder GF and Egelman EH; "Archael Flagellin Combines a Bacterial Type IV Pilin Domain with an Immunoglobulin-like Domain"; PNAS early edition; 30. 08. 2016