Blasenentzündung: Wenn Bakterien die Angel auswerfen
Wie gelingt es Bakterien, die Innenwand einer Harnblase zu besiedeln? Der Berliner Forscher Adam Lange hat die feinen Fortsätze von E. coli-Bakterien analysiert – dank dieser „Pili“ könnten sich die Einzeller gezielt an die menschliche Schleimhaut anheften. Mit einer Kombination moderner Bildgebungstechnologien dringen die Biophysiker am FMP (Leibniz-Institut für Molekulare Pharmakologie) dabei bis in atomare Details vor. Motiviert wird ihre Forschung durch die wachsende Zahl von Antibiotikaresistenzen: Die Aufklärung von Schlüsselstrukturen pathogener Keime schafft Ansatzpunkte für neue Therapeutika.
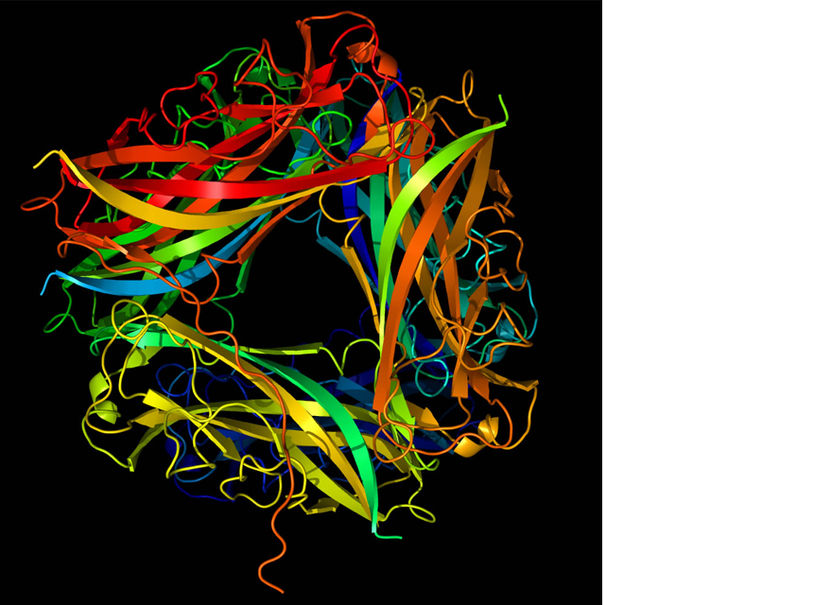
Cartoon-Darstellung der Pilus-Struktur. Gezeigt werden sechs Pilusbausteine in einer Ansicht von oben.
Adam Lange, FMP
Harnwegsinfektionen sind die häufigsten bakteriellen Entzündungen in Deutschland. Jede zweite Frau erkrankt mindestens einmal in ihrem Leben an einer Blasenentzündung, besonders quälend sind ständig wiederkehrende Infektionen. Dabei verfügt der Körper eigentlich über eine schlichte, aber effektive Abwehrmaßnahme: Geraten Bakterien in den Harntrakt, werden die Eindringlinge mit dem Urin wieder herausgespült. In manchen Fällen aber gelingt es ihnen, an der Innenwand der Blase Halt zu finden: So wie Moos in einem reißenden Fluss gedeihen kann, besiedeln die Einzeller dann die Schleimhäute der Harnwege – mit schmerzhaften Folgen.
Der überwiegende Teil der Harnwegsinfekte wird von Escherichia coli-Bakterien verursacht, die normalerweise im menschlichen Darm leben, und die auf ihrer Oberfläche mit Hunderten feinster Härchen, den sogenannten Pili bestückt sind. „Man kann sich jeden einzelnen Pilus wie eine Angelleine vorstellen“, sagt Adam Lange. „Die Leine ist fest und zugleich flexibel, und an ihrem Ende sitzt ein weiterer Eiweißbaustein, der sich wie ein Angelhaken spezifisch an bestimmte Moleküle der menschlichen Schleimhaut anheftet.“ Adam Lange untersuchte mit seiner Gruppe den Pilus vom Typ 1, durch den sich Darmbakterien an der Blaseninnenwand festsetzen. Er ist aus rund 3000 identischen Eiweißbausteinen aufgebaut, die perfekt ineinander passen und sich zu einer gewundenen Helix aneinanderlagern.
Die Analyse eines solch komplexen Gebildes ist für Strukturbiologen eine besondere Herausforderung, da der Molekülkomplex weder auskristallisiert noch löslich ist. Adam Lange, der vor zwei Jahren vom Europäischen Forschungsrat (ERC) eine Förderung über 1,5 Millionen Euro für die Erforschung von Infektionsmechanismen erhalten hat, ging das Problem daher mit einer Kombination dreier verschiedener Methoden an. Durch Elektronenmikroskopie wurde der Aufbau eines Pilus grob ersichtlich; mittels Kernspinresonanz (NMR) ermittelte er die atomare Struktur der einzelnen Eiweißbausteine. Und außerdem setzte er auch die noch junge Methode der Festkörper-NMR ein, mit der sich unlösliche Proteinaggregate analysieren lassen und zu deren Pionieren Lange gehört. „Je genauer wir Krankheitserreger bis hin ins atomare Detail verstehen, desto eher wird es gelingen, neue Wirkstoffe zu finden, die gezielt Infektionsmechanismen blockieren“, sagt Lange.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.