Per Anhalter zu einer besseren Wirkstoffabgabe
Mit Hilfe von Blutzellen können Nanopartikel biologische Barrieren überwinden
Als Samir Mitragotri Ende der 1980er Jahre als Student an der Universität von Mumbai eintrat, gab es nur eine akademische Option für Studenten im Studiengang "Technologie": Chemieingenieurwesen. "Keiner von uns wusste, was Chemieingenieurwesen ist, als wir es studierten, und ich war mir ziemlich sicher, dass ich in einem petrochemischen Unternehmen arbeiten würde", sagt er. Doch als er sich entschloss, sein Studium am MIT fortzusetzen, entdeckte er etwas, das sein Leben für immer verändern würde: die Biologie. "Es war eine echte Öffnung, die Idee, dass Ingenieure einen Platz in der Biologie haben und dass es biologische Probleme gibt, die von Ingenieuren auf einzigartige Weise angegangen werden können." Heute ist Mitragotri der Hiller-Professor für Bioengineering und Hansjörg Wyss Professor für Biological Inspired Engineering am Wyss Institute und an der John A. Paulson School of Engineering and Applied Sciences (SEAS) in Harvard.
"Mein Labor existiert gerne an der Schnittstelle oder Grenze zwischen verschiedenen Disziplinen. Im Laufe der Jahre habe ich erkannt, dass es viele interessante Möglichkeiten an Schnittstellen gibt, die man sich nur schwer vorstellen kann, wenn man ausschließlich in einem Bereich arbeitet. Manchmal gibt es eine Lösung, die auf ein Problem wartet, oder ein Problem, das auf eine Lösung wartet und die am besten an dieser Schnittstelle zusammenpassen", sagt er. Aufgrund seiner natürlichen Affinität zu Kanten und Grenzen ist es passend, dass sich seine Forschung auf biologische Barrieren konzentriert.
Biologische Barrieren existieren auf mehreren Ebenen in unserem Körper. Die äußerste Barriere ist unsere Haut, die wertvolle Feuchtigkeit (und alle unsere Innereien) und schädliche fremde Eindringlinge, von Viren über Insekten bis hin zur Sonne, fernhält. Im Inneren des Körpers bilden die Verbindungen zwischen den Zellen, die unsere Arterien, Venen und Kapillaren bilden, eine Barriere, die unser Blut durch unsere Gefäße fließen lässt, anstatt überall zu versickern. Unsere Mägen sind mit Säure gefüllt, die Krankheitserreger in unserer Nahrung abtötet und auflöst. Und unser Immunsystem funktioniert wie eine Polizei, die schädliche Bakterien, Viren, Parasiten und sogar Krebszellen erkennt, aufspürt und zerstört. Zu verstehen, wie diese verschiedenen Arten von Barrieren funktionieren und wie man den Fluss der Moleküle über sie steuern kann, ist das, was Mitragotri am Morgen aus dem Bett bringt.
"Wir Ingenieure machen Dinge in der Biologie, die ganz anders sind als das, was Biologen normalerweise tun. Einige davon sind vielleicht Kreativität, andere vielleicht Unwissenheit", sagt er lachend. "Während es in der Biologie traditionell darum geht zu beobachten, wie sich die Dinge in der Natur verhalten, sage ich meinen Schülern, dass der beste Weg, etwas über eine Barriere zu lernen, darin besteht, sie zu stören und zu sehen, wie sie reagiert. Wenn wir dies mit all den Barrieren tun, kann diese Wissensdatenbank die Grundlage für die Schaffung besserer Methoden zur Verabreichung von Medikamenten bilden. Wenn wir wissen, wie weit wir eine Barriere stören können, ohne sie zu gefährden, gibt uns das einen Hinweis darauf, wie man am besten ein Medikament über sie bringt."
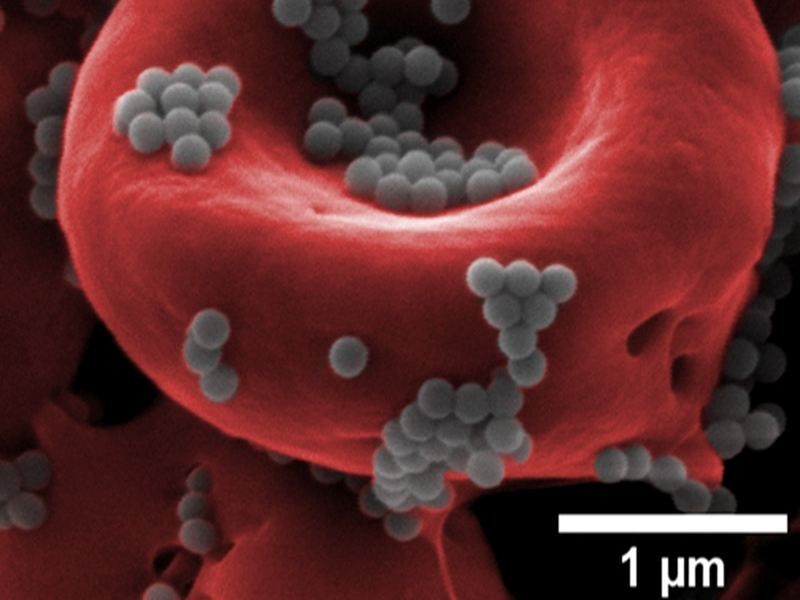
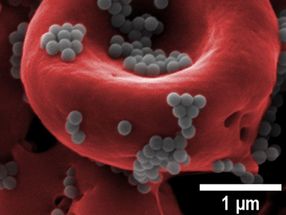
Nanopartikel (grau) können eine Mitfahrgelegenheit auf roten Blutkörperchen (rot) bilden, um die Entdeckung durch die Leber zu vermeiden und über einen längeren Zeitraum höhere Dosen von Medikamenten zu liefern als freischwimmende Nanopartikel, die über das Blut verabreicht werden.
Wyss Institute at Harvard University
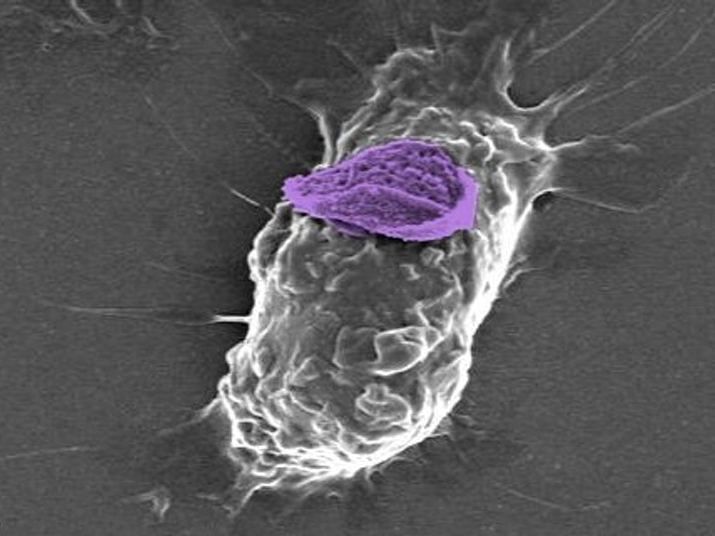
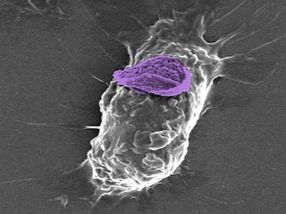
Ein Makrophage, oder weiße Blutkörperchen, kann einen Nanopartikel "Rucksack" (violett) tief in das Gewebe tragen, um bestimmte Verletzungs- und Krankheitsstellen zu erreichen.
Wyss Institute at Harvard University
Viele Arzneimittel sind kleine Moleküle, die oral als Pille oder Flüssigkeit eingenommen werden und über den Darm in den Körper aufgenommen werden. Die Arzneimittellandschaft beginnt sich jedoch auf biologische Produkte wie Impfstoffe, Gentherapien und rekombinante Proteine zu verlagern, die alle vom Magen zerstört werden und direkt injiziert werden müssen. Beim Versuch, die Barriere des Darms durch Injektion ins Blut zu umgehen, stoßen diese Medikamente jedoch auf neue Feinde: die Leber und die Milz, die zusammen eine Art dynamische Barriere bilden, die Schadstoffe aus dem Körper fernhält. "Das sind die klärenden Organe, ihre Kapillaren sind mit Makrophagen ausgekleidet, die immer auf der Suche nach Fremdstoffen sind", erklärt Mitragotri. "Sie sind besonders gut im Reinigen von Nanopartikeln. Wenn Sie einem Patienten ein in Nanopartikeln eingekapseltes Tumorbekämpfungsmittel über eine Infusion verabreichen, gelangen weniger als 1% des Medikaments tatsächlich an den Tumor."
Motiviert durch diese und andere schlimme Statistiken machten sich Mitragotri und sein Team daran, ein System zu entwickeln, das verhindern könnte, dass Nanopartikel aus dem Blut entfernt werden, bevor sie ihr Zielgewebe erreichen. Sie erkannten schnell, dass Blutzellen von Natur aus in der Lage sind, all das zu tun, was sie von Nanopartikeln erwarten: Rote Blutkörperchen können bis zu vier Monate lang leben und einmal pro Minute durch die Leber wandern, ohne gereinigt zu werden; Makrophagen (oder weiße Blutkörperchen) können tief in das Gewebe eindringen und sich an Entzündungsstellen (z.B. Tumoren) ansiedeln; und Blutplättchen binden sich bei Verletzungen selektiv an bestimmte Stellen innerhalb des Gefäßsystems. Könnten Nanopartikel die besonderen Fähigkeiten dieser Zellen nutzen, um zu verhindern, dass sie vom Blut befreit werden und ihre Medikamente besser abgeben?
Vor über einem Jahrzehnt haben Mitragotri und Kollegen von der University of California, Santa Barbara, Nanopartikel an die roten Blutkörperchen der Nagetiere gehängt und diese wieder in die Blutbahnen der Nagetiere eingebracht. Fast wie durch ein Wunder ignorierten die Makrophagen der Nagetiere die Nanopartikel und behandelten die roten Blutkörperchen normal, so dass sie im Blut bleiben konnten, anstatt von der Leber gereinigt zu werden. "Das war der erste Sieg", erinnert sich Mitragotri.
Schließlich verschwanden die Nanopartikel aus dem zirkulierenden Blut, aber die roten Blutkörperchen nicht. "Wo sind die Nanopartikel hin? In jüngsten Studien in Zusammenarbeit mit Forschern der University of Pennsylvania haben wir herausgefunden, dass sie von den roten Blutkörperchen in den Kapillaren, die im Durchmesser kleiner sind als die Blutkörperchen selbst, gequetscht wurden", sagt Mitragotri. Als die roten Blutkörperchen durch diese Kapillaren gequetscht wurden, scherten sich die Nanopartikel ab und deponierten sich in dem Organ, in dem sich diese Kapillaren befanden. Durch die Veränderung des Blutgefäßes, in das die rotblütigen, zellgebundenen Nanopartikel injiziert werden, konnten die Forscher sicherstellen, dass die Nanopartikel in dem Organ landen, das sich hinter der Injektionsstelle befindet. Als die Forscher die "getrampelten" Nanopartikel in die Halsschlagadern von Mäusen einführten, landeten 10% von ihnen im Gehirn, verglichen mit 1% bei der Injektion von Nanopartikeln selbst; eine zehnfache Steigerung der Lieferfähigkeit.
In seiner neuesten Arbeit zeigten Mitragotri und Kollegen, dass diese Trampmethode in mehreren Organen bei Mäusen und Schweinen sowie in der ganzen menschlichen Lunge funktioniert, wo sich ganze 41% der ins Blut eingeführten Nanopartikel in der Lunge ablagern. "In dieser Studie", schreiben die Autoren, "haben wir das ursprüngliche Konzept des Trampens mit roten Blutkörperchen von einem Prototyp mit bescheidener Entbindung bei Mäusen bis an den Rand der Kartierung der klinischen Studien gebracht".
Neben den vielen möglichen Anwendungen der Anheftung von Nanopartikeln an rote Blutkörperchen untersucht Mitragotris Labor auch das Trampen auf Monozyten, den Zellen, die sich zu den Makrophagen differenzieren, die Krankheiten wie Krebs aktiv bekämpfen. "Monozyten fressen Nanopartikel, wenn man sie direkt anbringt, also mussten wir herausfinden, wie wir dieses Problem überwinden können", sagt Mitragotri. "Wir entdeckten, dass Monozyten viel Wert darauf legen, ob die Partikel rund oder scheibenförmig, hart oder weich sind. Es stellte sich heraus, dass sie keine scheibenförmigen, weichen Nanopartikel verinnerlichen können, also haben wir das gemacht." Die Monozyten kamen erwartungsgemäß hinter diesen Nanopartikeln her, hielten sich dann aber einfach auf ihrer Oberfläche fest, ohne sie zu verschlingen. Als die Forscher mit diesen "Rucksäcken" Monozyten dazu brachten, eine Endothelbarriere zu durchqueren, die eine Blutgefäßwand nachahmt, trugen die Monozyten ihre Rucksäcke mit sich und boten so eine effektive Transportmethode, um Medikamente in ihr Zielgewebe zu transportieren.
Mitragotri und seine Kollegen nutzen diese Strategie jetzt nicht nur, um Medikamente an ein Ziel zu liefern, sondern auch, um die Makrophagen selbst zu kontrollieren. Makrophagen verändern ihre physikalische Form und chemische Prozesse als Reaktion auf ihre Umgebung - das ist auch der Grund, warum sie so gute Verteidiger sind. Aber Tumore haben einen raffinierten Mechanismus entwickelt, Makrophagen "auszuschalten", wenn sie ankommen, um den Tumor zu töten; so können fast 50% eines gegebenen Tumors aus ruhenden Makrophagen bestehen. "Wir denken, dass wir mit dieser Methode den richtigen Auslöser für die Makrophagen liefern können, so dass sie auf den richtigen Typ für die Bekämpfung verschiedener Krankheiten polarisiert werden können", sagt Mitragotri. "Wir befinden uns noch in der Anfangsphase im Labor."
Das Labor ist auch mitten in einem Projekt zur Herstellung von Partikeln, die die Form und Elastizität von Blutplättchen teilen und spezielle Proteine auf ihrer Oberfläche tragen, die sie an die Stelle eines Blutgefäßbruchs bringen. "Das Hauptproblem bei inneren Blutungen ist, dass der Patient so viel Blut verliert, dass seine eigenen Blutplättchen nicht schnell genug ein Gerinnsel bilden können, um es zu stoppen", erklärt Mitragotri. "Die Idee mit dieser Strategie ist, diese "künstlichen Blutplättchen" zu injizieren, damit sie schnell zu einer Stelle mit inneren Blutungen gehen und einen Stopfen bilden können, um einen Patienten am Leben zu halten, bis er das Krankenhaus erreicht."
Als eines der neuesten Mitglieder der Kernfakultät des Wyss Instituts freut sich Mitragotri, das volle Potenzial für Synergien zwischen seiner Forschung und der seiner Kollegen zu entdecken. "Der Beitritt zum Wyss Institut war sehr attraktiv, weil es an der Schnittstelle zwischen Entdeckung und Übersetzung liegt. Während wir uns natürlich auf den Bereich Immunmaterialien konzentrieren, haben wir bereits Gespräche über die Zusammenarbeit mit dem größeren Wyss Ökosystem begonnen, und ich kann es kaum erwarten, was uns einfällt."
"Samirs natürlich interdisziplinäre, kreative Herangehensweise an seine Forschung erlaubt es ihm, Lösungen zu finden, wo andere nur Probleme sehen, und wir sind begeistert, ihn als Mitglied des Wyss Institute zu haben", sagt Dr. Donald Ingber, der Gründungsdirektor des Wyss Institute, der auch der Judah Folkman Professor für Gefäßbiologie an der HMS und das Vascular Biology Program am Boston Children's Hospital ist, sowie Professor für Bioengineering an der Harvard John A. Paulson School of Engineering and Applied Sciences.