Multidisziplinäre Studie regt neue Strategie zur Medikamentenentwicklung an
Eine Frage der Beweglichkeit
In einer Studie zu einem Zielprotein in der Krebsforschung haben Wissenschaftler aus der akademischen und industriellen Forschung einen ungewöhnlichen Zusammenhang zwischen der Flexibilität der Bindungsstellen und der Verweildauer des Wirkstoffs am Zielprotein entdeckt. Das Forschungsprojekt ist Teil der Arbeit des „Kinetics for Drug Discovery“ (K4DD) Konsortiums und wurde durch die „Innovative Medicines Initiative“ gefördert.
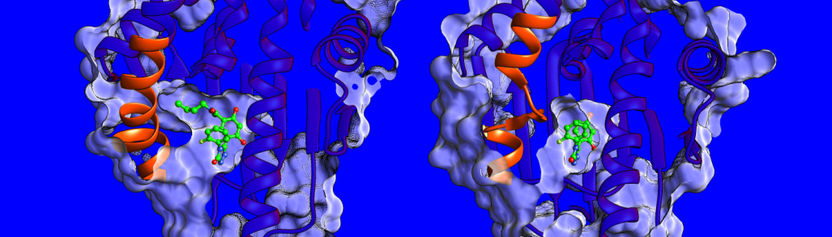
Unterschiede in der Struktur und Dynamik der Helix-Region (in orange) am HSP90-Protein, an das zwei verschiedene Inhibitoren (in grün) gebunden sind, beeinflussen die Form der Bindestelle (in hellblau) und die Geschwindigkeit, mit der sich die Komplexe bilden und wieder auseinander fallen. Der Komplex aus Protein und Inhibitor links hat eine längere Verweildauer. Überraschenderweise wird die Bindung dort durch die höhere Beweglichkeit der Helix-Region im gebundenen Komplex entropisch gesteuert.
Heidelberger Institut für Theoretische Studien (HITS)
Die meisten Medikamente wirken, indem sie an ein Zielprotein binden und so dessen normale Funktion behindern. Traditionell haben Wissenschaftler dafür vor allem nach Substanzen gesucht, die besonders affin sind, also fest an das Zielprotein binden: Je stärker die Bindung des Wirkstoffs, desto größer der Effekt. Doch Medikamente müssen in lebenden Organismen unter den sich dort ständig ändernden Bedingungen wirken. Deshalb setzt sich in der Wissenschaft mehr und mehr die These durch, dass bei der Medikamentenentwicklung nicht nur Affinität und Thermodynamik optimiert werden müssen. Es kommt auch auf die Verweildauer des Wirkstoffs am Zielprotein und seine Kinetik an, also auf den zeitlichen Ablauf der chemischen Prozesse.
Kinetik auf dem Prüfstand: Untersuchung eines Zielproteins aus der Krebsforschung
Ein multidisziplinäres Team aus Wissenschaftlern der K4DD Partner Merck KGaA (Darmstadt), des Heidelberger Instituts für Theoretische Studien (HITS) und des Instituto de Biologia Experimental e Tecnológica (iBET, Lissabon) hat deshalb mit modernen experimentellen und theoretischen Methoden die Faktoren untersucht, die die Verweildauer von Hemmstoffen an Zielproteinen bestimmen. Dafür nutzten sie ein in der Krebsforschung häufig getestetes Protein mit dem Namen Hitzeschockprotein 90 (HSP90). Wird HSP90 inhibiert, also gehemmt, kann der Zellzyklus unterbrochen und möglicherweise Tumoren daran gehindert werden, weiter zu wachsen.
Überraschende Ergebnisse: höhere Beweglichkeit der Bindungsstelle führt zu längerer Verweildauer
“Wir wissen zurzeit nur wenig über die Faktoren, die die Verweildauer der Wirkstoffe beeinflussen. Deshalb haben wir Thermodynamik und Kinetik gemessen, die Struktur von Komplexen aus HSP90 und Inhibitoren bestimmt, und die Dynamik der Komplexen simuliert“, berichtet Dr. Marta Amaral, eine der Erstautorinnen. Diese Strukturen, die mit Röntgenkristallographie bestimmt wurden, zeigten, dass an den Bindungsstellen zwei unterschiedliche Elemente vorhanden sein können: entweder eine Helix oder eine Schleife. Komplexe mit einer Helix-Struktur an der Bindungsstelle binden den Wirkstoff länger, fanden die Wissenschaftler heraus. „Wir waren sehr erstaunt darüber, dass ein wichtiger Faktor für die lange Verweildauer die größere Beweglichkeit der Helix-Region an der Bindestelle ist, wenn ein Inhibitor daran gebunden ist“, erzählt Professorin Rebecca Wade (HITS). Dieser ungewöhnliche Bindungsmechanismus bietet neue Möglichkeiten für die Wirkstoffentwicklung: In Zukunft könnten auch weniger stabile Zielproteine in Frage kommen, die auch beweglichere Formen des Proteins bei der Bindung erzeugen – ähnlich wie bei Skischuhen mit einem Innenfutter, das sich an den Fuß anpasst. Die Ergebnisse der Studie eröffnen neue Wege, effektive Wirkstoffkandidaten mit kinetisch und thermodynamisch optimalen Eigenschaften zu finden.